2026年新高考5年真题高中化学全一册通用版广东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题高中化学全一册通用版广东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第7页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
19. (14分)钛单质及其化合物在航空、航天、催化等领域应用广泛。
(1) 基态Ti原子的价层电子排布式为
(2) 298 K下,反应$\mathrm{TiO_2(s) + 2C(s) + 2Cl_2(g) \longrightarrow TiCl_4(g) + 2CO(g)}$的$\Delta H < 0$、$\Delta S > 0$,则298 K下该反应
(3) 以$\mathrm{TiCl_4}$为原料可制备$\mathrm{TiCl_3}$。将5.0 mol $\mathrm{TiCl_4}$与10.0 mol Ti放入容积为$V_0$ L的恒容密闭容器中,反应体系存在下列过程。

①$\Delta H_1 =$
②不同温度下,平衡时反应体系的组成如图。曲线Ⅰ对应的物质为

③温度$T_0$ K下,$n[\mathrm{TiCl_4(g)}] =$
(4) 钛基催化剂可以催化储氢物质肼($\mathrm{N_2H_4}$)的分解反应:
(e) $\mathrm{N_2H_4 \longrightarrow N_2 + 2H_2}$
(f) $\mathrm{3N_2H_4 \longrightarrow N_2 + 4NH_3}$
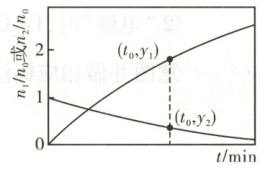
为研究某钛基催化剂对上述反应的影响,以肼的水溶液为原料(含$\mathrm{N_2H_4}$的物质的量为$n_0$),进行实验,得到$n_1/n_0$、$n_2/n_0$随时间t变化的曲线如图。其中,$n_1$为$\mathrm{H_2}$与$\mathrm{N_2}$的物质的量之和;$n_2$为剩余$\mathrm{N_2H_4}$的物质的量。设$n_e$为0~t时间段内反应(e)消耗$\mathrm{N_2H_4}$的物质的量,该时间段内,本体系中催化剂的选择性用$\frac{n_e}{n_0 - n_2} × 100\%$表示。
①0~$t_0$ min内,$\mathrm{N_2H_4}$的转化率为
②0~$t_0$ min内,催化剂的选择性为
(1) 基态Ti原子的价层电子排布式为
3d²4s²
。(2) 298 K下,反应$\mathrm{TiO_2(s) + 2C(s) + 2Cl_2(g) \longrightarrow TiCl_4(g) + 2CO(g)}$的$\Delta H < 0$、$\Delta S > 0$,则298 K下该反应
能
(填“能”或“不能”)自发进行。(3) 以$\mathrm{TiCl_4}$为原料可制备$\mathrm{TiCl_3}$。将5.0 mol $\mathrm{TiCl_4}$与10.0 mol Ti放入容积为$V_0$ L的恒容密闭容器中,反应体系存在下列过程。

①$\Delta H_1 =$
-267.8
kJ·mol⁻¹。②不同温度下,平衡时反应体系的组成如图。曲线Ⅰ对应的物质为
TiCl₂(s)
。
③温度$T_0$ K下,$n[\mathrm{TiCl_4(g)}] =$
0.5
mol,反应(c)的平衡常数$K =$$\frac{(\frac{6.0}{V_0})^4}{(\frac{0.5}{V_0})^3}$
(列出算式,无须化简)。(4) 钛基催化剂可以催化储氢物质肼($\mathrm{N_2H_4}$)的分解反应:

(e) $\mathrm{N_2H_4 \longrightarrow N_2 + 2H_2}$
(f) $\mathrm{3N_2H_4 \longrightarrow N_2 + 4NH_3}$
为研究某钛基催化剂对上述反应的影响,以肼的水溶液为原料(含$\mathrm{N_2H_4}$的物质的量为$n_0$),进行实验,得到$n_1/n_0$、$n_2/n_0$随时间t变化的曲线如图。其中,$n_1$为$\mathrm{H_2}$与$\mathrm{N_2}$的物质的量之和;$n_2$为剩余$\mathrm{N_2H_4}$的物质的量。设$n_e$为0~t时间段内反应(e)消耗$\mathrm{N_2H_4}$的物质的量,该时间段内,本体系中催化剂的选择性用$\frac{n_e}{n_0 - n_2} × 100\%$表示。
①0~$t_0$ min内,$\mathrm{N_2H_4}$的转化率为
(1 - y₂)×100%
(用含$y_2$的代数式表示)。②0~$t_0$ min内,催化剂的选择性为
$\frac{3y₁ + y₂ - 1}{8 - 8y₂}×100%$
(用含$y_1$与$y_2$的代数式表示,写出推导过程)。
答案:
19.参考答案
(1)3d²4s²
(2)能
$(3)① - 267.8 ②TiCl₂(s) ③0.5 (\frac{(\frac{6.0}{V_0})^4}{(\frac{0.5}{V_0})^3})$
(4)①(1 - y₂)×100% ②由图可知,0~t₀min内,反应消耗肼(N₂H₄)的物质的量为n₀(1 - y₂),生成的N₂和H₂的物质的量之和为n₀y₁,根据反应前后原子个数守恒,可得反应(f)生成的$n(NH₃)=\frac{6n₀(1 - y₂)-2n₀y₁}{4},$则反应(f)消耗的N₂H₄的物质的量$n_n=\frac{6n₀(1 - y₂)-2n₀y₁}{4}×\frac{3}{4},$反应(e)消耗的N₂H₄的物质的量n_e为$n₀(1 - y₂)-\frac{6n₀(1 - y₂)-2n₀y₁}{4}×\frac{3}{4},$则本体系中催化剂的选择性$=\frac{n_e}{n_0 - n_2}×100%=\frac{n₀(1 - y₂)-\frac{6n₀(1 - y₂)-2n₀y₁}{4}×\frac{3}{4}}{n₀ - n₀y₂}×100%=\frac{(1 - y₂)-\frac{9(1 - y₂)-3y₁}{8}}{1 - y₂}×100%=\frac{3y₁ + y₂ - 1}{8 - 8y₂}×100%。$
命题意图本题围绕钛及其化合物,涉及化学反应平衡、盖斯定律、反应自发等知识,体现了“变化观念与平衡思想”等化学学科核心素养。
解题思路
(2)该反应的ΔH<0、ΔS>0,则根据ΔG=ΔH - TΔS<0反应可自发进行可知,该反应在298K下能自发进行。
(3)①根据盖斯定律反应c - 2×反应b=反应a,则ΔH₁=(+132.4 - 2×200.1)kJ·mol⁻¹=-267.8kJ·mol⁻¹。②反应(a)为放热反应,反应(b)为吸热反应,升高温度,反应(a)平衡逆向移动、反应(b)平衡正向移动,TiCl₂(s)的物质的量减小,所以曲线Ⅰ对应的物质为TiCl₂(s),曲线Ⅱ对应的物质为TiCl₃(g)。③温度T₀K下,n[TiCl₂(s)]=8.5mol,n[TiCl₃(g)]=6.0mol,n[TiCl₄(s)]=n[TiCl₂(s)]=0mol,根据钛元素守恒,可推出n[TiCl₄(g)]=(10.0 + 5.0 - 6.0 - 8.5)mol=0.5mol。容器的容积为V₀L,$c[TiCl₄(g)]=\frac{0.5}{V_0}mol·L⁻¹,$$c[TiCl₃(g)]=\frac{6.0}{V_0}mol·L⁻¹,$反应(c)的平衡常数$K=\frac{c^4[TiCl₃(g)]}{c^3[TiCl₄(g)]}=\frac{(\frac{6.0}{V_0})^4}{(\frac{0.5}{V_0})^3}。$
(4)①因为肼(N₂H₄)为反应物,随着反应的进行,肼的含量逐渐下降,起始时n₂/n₀=1,t₀min时,n₂/n₀=y₂,则0~t₀min内,N₂H₄的转化率为$\frac{n₀ - n₀y₂}{n₀}×100%=(1 - y₂)×100%。$
(1)3d²4s²
(2)能
$(3)① - 267.8 ②TiCl₂(s) ③0.5 (\frac{(\frac{6.0}{V_0})^4}{(\frac{0.5}{V_0})^3})$
(4)①(1 - y₂)×100% ②由图可知,0~t₀min内,反应消耗肼(N₂H₄)的物质的量为n₀(1 - y₂),生成的N₂和H₂的物质的量之和为n₀y₁,根据反应前后原子个数守恒,可得反应(f)生成的$n(NH₃)=\frac{6n₀(1 - y₂)-2n₀y₁}{4},$则反应(f)消耗的N₂H₄的物质的量$n_n=\frac{6n₀(1 - y₂)-2n₀y₁}{4}×\frac{3}{4},$反应(e)消耗的N₂H₄的物质的量n_e为$n₀(1 - y₂)-\frac{6n₀(1 - y₂)-2n₀y₁}{4}×\frac{3}{4},$则本体系中催化剂的选择性$=\frac{n_e}{n_0 - n_2}×100%=\frac{n₀(1 - y₂)-\frac{6n₀(1 - y₂)-2n₀y₁}{4}×\frac{3}{4}}{n₀ - n₀y₂}×100%=\frac{(1 - y₂)-\frac{9(1 - y₂)-3y₁}{8}}{1 - y₂}×100%=\frac{3y₁ + y₂ - 1}{8 - 8y₂}×100%。$
命题意图本题围绕钛及其化合物,涉及化学反应平衡、盖斯定律、反应自发等知识,体现了“变化观念与平衡思想”等化学学科核心素养。
解题思路
(2)该反应的ΔH<0、ΔS>0,则根据ΔG=ΔH - TΔS<0反应可自发进行可知,该反应在298K下能自发进行。
(3)①根据盖斯定律反应c - 2×反应b=反应a,则ΔH₁=(+132.4 - 2×200.1)kJ·mol⁻¹=-267.8kJ·mol⁻¹。②反应(a)为放热反应,反应(b)为吸热反应,升高温度,反应(a)平衡逆向移动、反应(b)平衡正向移动,TiCl₂(s)的物质的量减小,所以曲线Ⅰ对应的物质为TiCl₂(s),曲线Ⅱ对应的物质为TiCl₃(g)。③温度T₀K下,n[TiCl₂(s)]=8.5mol,n[TiCl₃(g)]=6.0mol,n[TiCl₄(s)]=n[TiCl₂(s)]=0mol,根据钛元素守恒,可推出n[TiCl₄(g)]=(10.0 + 5.0 - 6.0 - 8.5)mol=0.5mol。容器的容积为V₀L,$c[TiCl₄(g)]=\frac{0.5}{V_0}mol·L⁻¹,$$c[TiCl₃(g)]=\frac{6.0}{V_0}mol·L⁻¹,$反应(c)的平衡常数$K=\frac{c^4[TiCl₃(g)]}{c^3[TiCl₄(g)]}=\frac{(\frac{6.0}{V_0})^4}{(\frac{0.5}{V_0})^3}。$
(4)①因为肼(N₂H₄)为反应物,随着反应的进行,肼的含量逐渐下降,起始时n₂/n₀=1,t₀min时,n₂/n₀=y₂,则0~t₀min内,N₂H₄的转化率为$\frac{n₀ - n₀y₂}{n₀}×100%=(1 - y₂)×100%。$
查看更多完整答案,请扫码查看


