2026年新高考5年真题高中化学全一册通用版广东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题高中化学全一册通用版广东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第5页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
18. (14分)我国是金属材料生产大国,绿色生产是必由之路。一种从多金属精矿中提取Fe、Cu、Ni等并探究新型绿色冶铁方法的工艺如下。
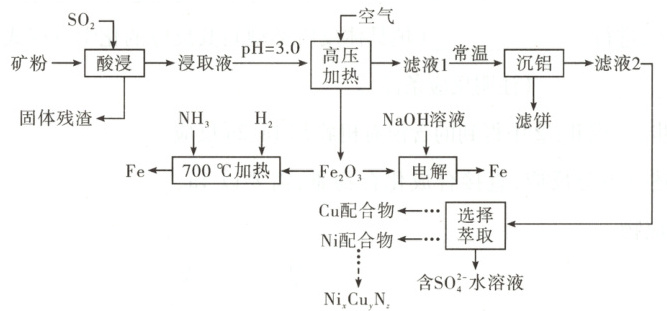
已知:多金属精矿中主要含有Fe、Al、Cu、Ni、O等元素。

(1) “酸浸”中,提高浸取速率的措施有
(2) “高压加热”时,生成$\mathrm{Fe_2O_3}$的离子方程式为:
(3) “沉铝”时,pH最高可调至
(4) “选择萃取”中,镍形成如图的配合物。镍易进入有机相的原因有
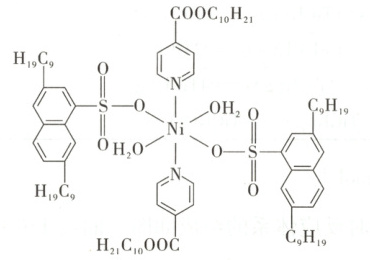
A. 镍与N、O形成配位键
B. 配位时$\mathrm{Ni^{2+}}$被还原
C. 配合物与水能形成分子间氢键
D. 烷基链具有疏水性
(5) $\mathrm{Ni_xCu_yN_z}$晶体的立方晶胞中原子所处位置如图。已知:同种位置原子相同,相邻原子间的最近距离之比$d_{\mathrm{Ni-Cu}}:d_{\mathrm{Ni-N}} = \sqrt{2}:1$,则$x:y:z =$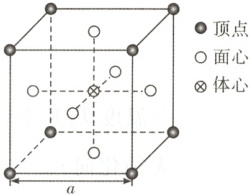
(6) ①“700 ℃加热”步骤中,混合气体中仅加少量$\mathrm{H_2}$,但借助工业合成氨的逆反应,可使Fe不断生成。该步骤发生反应的化学方程式为
和
②“电解”时,$\mathrm{Fe_2O_3}$颗粒分散于溶液中,以Fe片、石墨棒为电极,在虚线框中,画出电解池示意图并做相应标注。

③与传统高炉炼铁工艺相比,上述两种新型冶铁方法所体现“绿色化学”思想的共同点是

已知:多金属精矿中主要含有Fe、Al、Cu、Ni、O等元素。

(1) “酸浸”中,提高浸取速率的措施有
搅拌、粉碎多金属精矿、适当提高酸浸温度等(任写一条)
(写一条)。(2) “高压加热”时,生成$\mathrm{Fe_2O_3}$的离子方程式为:
4Fe²⁺
$\mathrm{+ O_2 +}$4
$\mathrm{H_2O \xrightarrow[\triangle]{高压}}$2
$\mathrm{Fe_2O_3 \downarrow +}$8
$\mathrm{H^+}$(3) “沉铝”时,pH最高可调至
5.0
(溶液体积变化可忽略)。已知:“滤液1”中$c(\mathrm{Cu^{2+}}) = 0.022$ mol·L⁻¹,$c(\mathrm{Ni^{2+}}) = 0.042$ mol·L⁻¹。(4) “选择萃取”中,镍形成如图的配合物。镍易进入有机相的原因有
AD
。
A. 镍与N、O形成配位键
B. 配位时$\mathrm{Ni^{2+}}$被还原
C. 配合物与水能形成分子间氢键
D. 烷基链具有疏水性
(5) $\mathrm{Ni_xCu_yN_z}$晶体的立方晶胞中原子所处位置如图。已知:同种位置原子相同,相邻原子间的最近距离之比$d_{\mathrm{Ni-Cu}}:d_{\mathrm{Ni-N}} = \sqrt{2}:1$,则$x:y:z =$
3:1:1
;晶体中与Cu原子最近且等距离的原子数目为12
。
(6) ①“700 ℃加热”步骤中,混合气体中仅加少量$\mathrm{H_2}$,但借助工业合成氨的逆反应,可使Fe不断生成。该步骤发生反应的化学方程式为
$2NH₃\xlongequal{Fe}N₂+3H₂$
和
$Fe₂O₃+3H₂\xlongequal{700℃}2Fe+3H₂O$
。②“电解”时,$\mathrm{Fe_2O_3}$颗粒分散于溶液中,以Fe片、石墨棒为电极,在虚线框中,画出电解池示意图并做相应标注。

③与传统高炉炼铁工艺相比,上述两种新型冶铁方法所体现“绿色化学”思想的共同点是
污染性气体排放少
(写一条)。
答案:
18.参考答案
(1)搅拌、粉碎多金属精矿、适当提高酸浸温度等(任写一条$) (2)4Fe²⁺ 4 2 8 (3)5.0 (4)AD (5)3:1:1 12 (6)①2NH₃\xlongequal{Fe}N₂+3H₂ Fe₂O₃+3H₂\xlongequal{700℃}2Fe+3H₂O $ ③污染性气体排放少
③污染性气体排放少
命题意图本题以多金属矿精矿绿色提取工艺为情境,涉及浸取速率、离子方程式书写、沉淀溶解平衡计算、配合物、晶胞结构与计算等知识,体现了“证据推理与模型认知”“宏观辨识与微观探析”等化学学科核心素养。
解题思路矿粉通入SO₂“酸浸”,浸取液中含有Fe²⁺、Cu²⁺、Ni²⁺、Al³⁺等,调节pH=3.0,通入空气“高压加热”得到Fe₂O₃,Fe₂O₃可以通过还原得到Fe单质,也可以通过“电解”得到Fe单质。滤液1在常温下“沉铝”,滤液2中含有Cu²⁺和Ni²⁺,“选择萃取”得到含SO₄²⁻的水溶液、Cu配合物和Ni配合物,最终得到产品NiₓCuₙN₂。
(3)由已知信息中K_sp数据可知,0.022mol·L⁻¹Cu²⁺开始沉淀时所需的$c(OH⁻)=\sqrt{\frac{2.2×10^{-20}}{0.022}}mol·L⁻¹=1×10⁻⁹mol·L⁻¹,$0.042mol·L⁻¹Ni²⁺开始沉淀时所需的$c(OH⁻)=\sqrt{\frac{5.5×10^{-16}}{0.042}}mol·L⁻¹=\sqrt{131×10⁻⁸}mol·L⁻¹>1×10⁻⁹mol·L⁻¹,$则Cu²⁺会先沉淀,而“沉铝”时,要保证Cu²⁺、Ni²⁺不沉淀,c(OH⁻)=1×10⁻⁹mol·L⁻¹时pH=5.0,所以溶液的pH最高可调至5.0。
(4)镍与N、O形成配位键,可以使镍进入有机相,A项符合题意。配体 中提供孤电子对的O原子带一个单位负电荷,其余配体不带电,整个配合物不显电性,形成配合物后,中心离子还是Ni²⁺,镍元素化合价不变,且与镍易进入有机相无关,B项不符合题意。配合物与水形成分子间氢键,但不能解释镍易进入有机相,C项不符合题意。亲水基磺酸根在水中与Ni²⁺形成配位键,而后Ni被配体包裹,配体外围烷基疏水,与H₂O分层,使镍易进入有机相,D项符合题意。
中提供孤电子对的O原子带一个单位负电荷,其余配体不带电,整个配合物不显电性,形成配合物后,中心离子还是Ni²⁺,镍元素化合价不变,且与镍易进入有机相无关,B项不符合题意。配合物与水形成分子间氢键,但不能解释镍易进入有机相,C项不符合题意。亲水基磺酸根在水中与Ni²⁺形成配位键,而后Ni被配体包裹,配体外围烷基疏水,与H₂O分层,使镍易进入有机相,D项符合题意。
(5)根据同种位置原子相同,相邻原子间的最近距离之比$d_Ni - Cu:d_Ni - N=\sqrt{2}:1。$晶胞边长为a,由几何关系可知,面心的原子与顶点的原子距离为$\frac{\sqrt{2}}{2}a,$面心的原子与体心的原子距离为$\frac{1}{2}a,$则晶胞中面心原子为Ni,有$6×\frac{1}{2}=3$个;顶点原子为Cu,有$8×\frac{1}{8}=1$个;体心的原子为N,有1个,则x:y:z=3:1:1。1个晶胞中与Cu原子最近且等距离的原子数目为$3×8×\frac{1}{2}=12。$
(6)②“电解”时,Fe₂O₃颗粒分散于溶液中,Fe₂O₃在铁片表面被还原得到铁单质,则Fe片为阴极。石墨棒为阳极,NaOH为电解质溶液。
18.参考答案
(1)搅拌、粉碎多金属精矿、适当提高酸浸温度等(任写一条$) (2)4Fe²⁺ 4 2 8 (3)5.0 (4)AD (5)3:1:1 12 (6)①2NH₃\xlongequal{Fe}N₂+3H₂ Fe₂O₃+3H₂\xlongequal{700℃}2Fe+3H₂O $
 ③污染性气体排放少
③污染性气体排放少命题意图本题以多金属矿精矿绿色提取工艺为情境,涉及浸取速率、离子方程式书写、沉淀溶解平衡计算、配合物、晶胞结构与计算等知识,体现了“证据推理与模型认知”“宏观辨识与微观探析”等化学学科核心素养。
解题思路矿粉通入SO₂“酸浸”,浸取液中含有Fe²⁺、Cu²⁺、Ni²⁺、Al³⁺等,调节pH=3.0,通入空气“高压加热”得到Fe₂O₃,Fe₂O₃可以通过还原得到Fe单质,也可以通过“电解”得到Fe单质。滤液1在常温下“沉铝”,滤液2中含有Cu²⁺和Ni²⁺,“选择萃取”得到含SO₄²⁻的水溶液、Cu配合物和Ni配合物,最终得到产品NiₓCuₙN₂。
(3)由已知信息中K_sp数据可知,0.022mol·L⁻¹Cu²⁺开始沉淀时所需的$c(OH⁻)=\sqrt{\frac{2.2×10^{-20}}{0.022}}mol·L⁻¹=1×10⁻⁹mol·L⁻¹,$0.042mol·L⁻¹Ni²⁺开始沉淀时所需的$c(OH⁻)=\sqrt{\frac{5.5×10^{-16}}{0.042}}mol·L⁻¹=\sqrt{131×10⁻⁸}mol·L⁻¹>1×10⁻⁹mol·L⁻¹,$则Cu²⁺会先沉淀,而“沉铝”时,要保证Cu²⁺、Ni²⁺不沉淀,c(OH⁻)=1×10⁻⁹mol·L⁻¹时pH=5.0,所以溶液的pH最高可调至5.0。
(4)镍与N、O形成配位键,可以使镍进入有机相,A项符合题意。配体
 中提供孤电子对的O原子带一个单位负电荷,其余配体不带电,整个配合物不显电性,形成配合物后,中心离子还是Ni²⁺,镍元素化合价不变,且与镍易进入有机相无关,B项不符合题意。配合物与水形成分子间氢键,但不能解释镍易进入有机相,C项不符合题意。亲水基磺酸根在水中与Ni²⁺形成配位键,而后Ni被配体包裹,配体外围烷基疏水,与H₂O分层,使镍易进入有机相,D项符合题意。
中提供孤电子对的O原子带一个单位负电荷,其余配体不带电,整个配合物不显电性,形成配合物后,中心离子还是Ni²⁺,镍元素化合价不变,且与镍易进入有机相无关,B项不符合题意。配合物与水形成分子间氢键,但不能解释镍易进入有机相,C项不符合题意。亲水基磺酸根在水中与Ni²⁺形成配位键,而后Ni被配体包裹,配体外围烷基疏水,与H₂O分层,使镍易进入有机相,D项符合题意。(5)根据同种位置原子相同,相邻原子间的最近距离之比$d_Ni - Cu:d_Ni - N=\sqrt{2}:1。$晶胞边长为a,由几何关系可知,面心的原子与顶点的原子距离为$\frac{\sqrt{2}}{2}a,$面心的原子与体心的原子距离为$\frac{1}{2}a,$则晶胞中面心原子为Ni,有$6×\frac{1}{2}=3$个;顶点原子为Cu,有$8×\frac{1}{8}=1$个;体心的原子为N,有1个,则x:y:z=3:1:1。1个晶胞中与Cu原子最近且等距离的原子数目为$3×8×\frac{1}{2}=12。$
(6)②“电解”时,Fe₂O₃颗粒分散于溶液中,Fe₂O₃在铁片表面被还原得到铁单质,则Fe片为阴极。石墨棒为阳极,NaOH为电解质溶液。
查看更多完整答案,请扫码查看


