2026年新高考5年真题高中化学全一册通用版广东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题高中化学全一册通用版广东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第71页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
4. [2025·河南卷,15T,14分]一种从预处理得到的贵金属合金粉[主要成分为Fe、Rh(铑)、Pt,含有少量SiO₂]中尽可能回收铑的工艺流程如下:
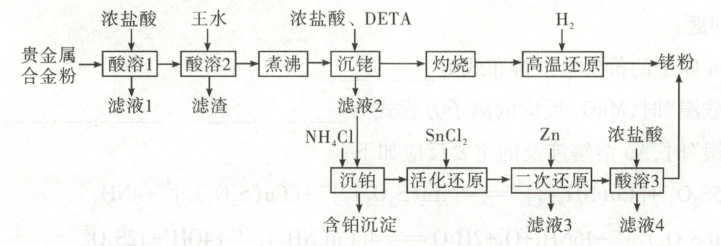
回答下列问题:
(1)“酸溶1”的目的是
(2)已知“酸溶2”中Rh转化为H₃[RhCl₆],则生成该物质的化学方程式为
(3)“沉铑”中得到的沉淀经“灼烧”后分解成铑单质,但夹杂少量Rh₂O₃和RhCl₃,则“高温还原”中发生反应的化学方程式为
(4)若“活化还原”在室温下进行,SnCl₂初始浓度为1.0×10⁻⁴mol·L⁻¹,为避免生成Sn(OH)₂沉淀,溶液适宜的pH为
A.2.0
B.4.0
C.6.0
(5)“活化还原”中,SnCl₂必须过量,其与Rh(Ⅲ)反应可生成[Rh(SnCl₃)₅]⁴⁻,提升了Rh的还原速率,该配离子中Rh的化合价为
(6)“酸溶3”的目的是

回答下列问题:
(1)“酸溶1”的目的是
溶解合金粉中的$Fe$
。(2)已知“酸溶2”中Rh转化为H₃[RhCl₆],则生成该物质的化学方程式为
$Rh + 6HCl + 3HNO_{3}= H_{3}[RhCl_{6}]+3NO_{2}\uparrow+3H_{2}O$
;“滤渣”的主要成分是$SiO_{2}$
(填化学式)。(3)“沉铑”中得到的沉淀经“灼烧”后分解成铑单质,但夹杂少量Rh₂O₃和RhCl₃,则“高温还原”中发生反应的化学方程式为
$Rh_{2}O_{3}+3H_{2}\xlongequal{高温}2Rh + 3H_{2}O$、$2RhCl_{3}+3H_{2}\xlongequal{高温}2Rh + 6HCl$
。(4)若“活化还原”在室温下进行,SnCl₂初始浓度为1.0×10⁻⁴mol·L⁻¹,为避免生成Sn(OH)₂沉淀,溶液适宜的pH为
A
(填标号)[已知Sn(OH)₂的Kₛₚ=5.5×10⁻²⁸]。A.2.0
B.4.0
C.6.0
(5)“活化还原”中,SnCl₂必须过量,其与Rh(Ⅲ)反应可生成[Rh(SnCl₃)₅]⁴⁻,提升了Rh的还原速率,该配离子中Rh的化合价为
+1
;反应中同时生成[SnCl₆]²⁻,Rh(Ⅲ)以[RhCl₆]³⁻计,则理论上SnCl₂和Rh(Ⅲ)反应的物质的量之比为6:1
。(6)“酸溶3”的目的是
溶解$Zn$、$Sn$,得到纯净的铑粉
。
答案:
4.参考答案
(1)溶解合金粉中的$Fe$
(2)$Rh + 6HCl + 3HNO_{3}= H_{3}[RhCl_{6}]+3NO_{2}\uparrow+3H_{2}O$ $SiO_{2}$
(3)$Rh_{2}O_{3}+3H_{2}\xlongequal{高温}2Rh + 3H_{2}O$、$2RhCl_{3}+3H_{2}\xlongequal{高温}2Rh + 6HCl$
(4)A
(5)+1 6:1
(6)溶解$Zn$、$Sn$,得到纯净的铑粉
命题意图:本题以从贵金属合金粉中回收铑的工艺流程为情境,考查操作目的、化学方程式书写、沉淀$pH$控制及涉及配合物的氧化还原反应等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路:
(2)“酸溶2”中$Rh$被氧化生成$H_{3}[RhCl_{6}]$,王水中浓硝酸被还原为$NO_{2}$。$SiO_{2}$不溶于王水,该过程中“滤渣”的主要成分为$SiO_{2}$。
(3)“高温还原”过程中,少量的$Rh_{2}O_{3}$和$RhCl_{3}$均被$H_{2}$还原为$Rh$,$Rh$的化合价均由 + 3降低至0。
(4)$SnCl_{2}$初始浓度为$1.0×10^{-4}mol· L^{-1}$,当恰好生成$Sn(OH)_{2}$沉淀时,$c(OH^{-})=\sqrt{\frac{K_{sp}[Sn(OH)_{2}]}{c(Sn^{2+})}}=\sqrt{\frac{5.5×10^{-28}}{1.0×10^{-4}}}mol· L^{-1}=\sqrt{5.5×10^{-24}}mol· L^{-1}$,则$c(H^{+})\approx4.3×10^{-3}mol· L^{-1}$,溶液$pH\approx2.4$,因此为避免生成$Sn(OH)_{2}$沉淀,$pH$应小于2.4,A项符合题意。
(5)配离子$[Rh(SnCl_{3})_{5}]^{4 - }$中,$Sn$是 + 2价,$Cl$是 - 1价,则$Rh$的化合价为 + 1。“活化还原”过程中$Rh$(Ⅲ)以$[RhCl_{6}]^{3 - }$计,反应中$[RhCl_{6}]^{3 - }$被还原为$[Rh(SnCl_{3})_{5}]^{4 - }$,$SnCl_{2}$为还原剂,部分被氧化为$[SnCl_{6}]^{2 - }$,且$[RhCl_{6}]^{3 - }\sim[SnCl_{6}]^{2 - }\sim2e^{-}$,同时部分$SnCl_{2}$结合一个$Cl^{-}$形成$[SnCl_{3}]^{-}$,作为新的配体,则每形成1个$[Rh(SnCl_{3})_{5}]^{4 - }$需要5个$SnCl_{2}$,因此理论上$SnCl_{2}$和$Rh$(Ⅲ)反应的物质的量之比为$(1 + 5):1 = 6:1$。
流程梳理

4.参考答案
(1)溶解合金粉中的$Fe$
(2)$Rh + 6HCl + 3HNO_{3}= H_{3}[RhCl_{6}]+3NO_{2}\uparrow+3H_{2}O$ $SiO_{2}$
(3)$Rh_{2}O_{3}+3H_{2}\xlongequal{高温}2Rh + 3H_{2}O$、$2RhCl_{3}+3H_{2}\xlongequal{高温}2Rh + 6HCl$
(4)A
(5)+1 6:1
(6)溶解$Zn$、$Sn$,得到纯净的铑粉
命题意图:本题以从贵金属合金粉中回收铑的工艺流程为情境,考查操作目的、化学方程式书写、沉淀$pH$控制及涉及配合物的氧化还原反应等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路:
(2)“酸溶2”中$Rh$被氧化生成$H_{3}[RhCl_{6}]$,王水中浓硝酸被还原为$NO_{2}$。$SiO_{2}$不溶于王水,该过程中“滤渣”的主要成分为$SiO_{2}$。
(3)“高温还原”过程中,少量的$Rh_{2}O_{3}$和$RhCl_{3}$均被$H_{2}$还原为$Rh$,$Rh$的化合价均由 + 3降低至0。
(4)$SnCl_{2}$初始浓度为$1.0×10^{-4}mol· L^{-1}$,当恰好生成$Sn(OH)_{2}$沉淀时,$c(OH^{-})=\sqrt{\frac{K_{sp}[Sn(OH)_{2}]}{c(Sn^{2+})}}=\sqrt{\frac{5.5×10^{-28}}{1.0×10^{-4}}}mol· L^{-1}=\sqrt{5.5×10^{-24}}mol· L^{-1}$,则$c(H^{+})\approx4.3×10^{-3}mol· L^{-1}$,溶液$pH\approx2.4$,因此为避免生成$Sn(OH)_{2}$沉淀,$pH$应小于2.4,A项符合题意。
(5)配离子$[Rh(SnCl_{3})_{5}]^{4 - }$中,$Sn$是 + 2价,$Cl$是 - 1价,则$Rh$的化合价为 + 1。“活化还原”过程中$Rh$(Ⅲ)以$[RhCl_{6}]^{3 - }$计,反应中$[RhCl_{6}]^{3 - }$被还原为$[Rh(SnCl_{3})_{5}]^{4 - }$,$SnCl_{2}$为还原剂,部分被氧化为$[SnCl_{6}]^{2 - }$,且$[RhCl_{6}]^{3 - }\sim[SnCl_{6}]^{2 - }\sim2e^{-}$,同时部分$SnCl_{2}$结合一个$Cl^{-}$形成$[SnCl_{3}]^{-}$,作为新的配体,则每形成1个$[Rh(SnCl_{3})_{5}]^{4 - }$需要5个$SnCl_{2}$,因此理论上$SnCl_{2}$和$Rh$(Ⅲ)反应的物质的量之比为$(1 + 5):1 = 6:1$。
流程梳理

5. [2025·陕西卷,16T,14分]一种综合回收电解锰工业废盐(主要成分为Mn²⁺、Mg²⁺、NH₄⁺的硫酸盐)的工艺流程如下。
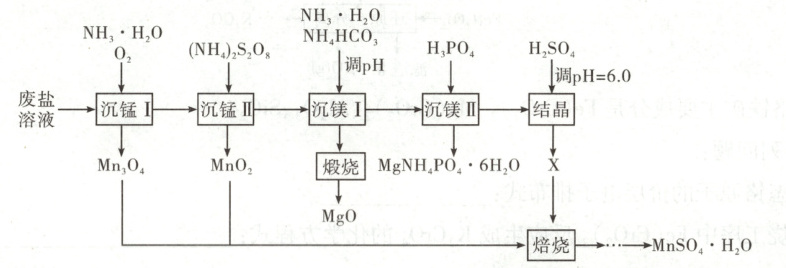
已知:①常温下Kₛₚ(MgCO₃)=10⁻⁵.¹⁷,Kₛₚ[Mg(OH)₂]=10⁻¹¹.²⁵,Kₛₚ[Mn(OH)₂]=10⁻¹².⁷²;
②S₂O₈²⁻结构式为 。
。
回答下列问题:
(1)制备废盐溶液时,为加快废盐溶解,可采取的措施有
(2)“沉锰Ⅰ”中,写出形成的Mn(OH)₂被氧化成Mn₃O₄的化学方程式
(3)“沉锰Ⅱ”中,过量的(NH₄)₂S₂O₈经加热水解去除,最终产物是NH₄HSO₄和
(4)“沉镁Ⅰ”中,当pH为8.0~10.2时,生成碱式碳酸镁[xMgCO₃·yMg(OH)₂·zH₂O],煅烧得到疏松的轻质MgO。pH过大时,不能得到轻质MgO的原因是
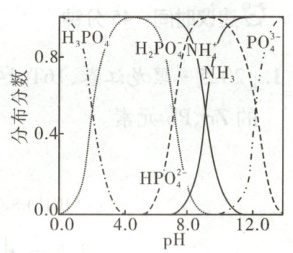
(5)“沉镁Ⅱ”中,加H₃PO₄至pH=8.0时,Mg²⁺沉淀完全;若加至pH=4.0时沉淀完全溶解,据图分析,写出沉淀溶解的离子方程式
(6)“结晶”中,产物X的化学式为
(7)“焙烧”中,Mn元素发生了

已知:①常温下Kₛₚ(MgCO₃)=10⁻⁵.¹⁷,Kₛₚ[Mg(OH)₂]=10⁻¹¹.²⁵,Kₛₚ[Mn(OH)₂]=10⁻¹².⁷²;
②S₂O₈²⁻结构式为
 。
。回答下列问题:
(1)制备废盐溶液时,为加快废盐溶解,可采取的措施有
搅拌、适当升温(答案合理即可)
、。(写出两种)(2)“沉锰Ⅰ”中,写出形成的Mn(OH)₂被氧化成Mn₃O₄的化学方程式
$6Mn(OH)_{2}+O_{2}=2Mn_{3}O_{4}+6H_{2}O$
。当Mg²⁺(c=10⁻⁰.⁶⁸mol·L⁻¹)将要开始沉淀时,溶液中剩余Mn²⁺浓度为$10^{-2.15}$
mol·L⁻¹。(3)“沉锰Ⅱ”中,过量的(NH₄)₂S₂O₈经加热水解去除,最终产物是NH₄HSO₄和
$O_{2}$
(填化学式)。(4)“沉镁Ⅰ”中,当pH为8.0~10.2时,生成碱式碳酸镁[xMgCO₃·yMg(OH)₂·zH₂O],煅烧得到疏松的轻质MgO。pH过大时,不能得到轻质MgO的原因是
$pH$过大时,沉淀中$MgCO_{3}$的比例降低,煅烧产生的$CO_{2}$气体减少,不能得到疏松的轻质$MgO$
。
(5)“沉镁Ⅱ”中,加H₃PO₄至pH=8.0时,Mg²⁺沉淀完全;若加至pH=4.0时沉淀完全溶解,据图分析,写出沉淀溶解的离子方程式
$MgNH_{4}PO_{4}·6H_{2}O+2H_{3}PO_{4}=Mg^{2+}+3H_{2}PO_{4}^{-}+NH_{4}^{+}+6H_{2}O$
。(6)“结晶”中,产物X的化学式为
$(NH_{4})_{2}SO_{4}$
。(7)“焙烧”中,Mn元素发生了
还原
(填“氧化”或“还原”)反应。
答案:
5.参考答案
(1)搅拌、适当升温(答案合理即可)
(2)$6Mn(OH)_{2}+O_{2}=2Mn_{3}O_{4}+6H_{2}O$ $10^{-2.15}$
(3)$O_{2}$
(4)$pH$过大时,沉淀中$MgCO_{3}$的比例降低,煅烧产生的$CO_{2}$气体减少,不能得到疏松的轻质$MgO$
(5)$MgNH_{4}PO_{4}·6H_{2}O+2H_{3}PO_{4}=Mg^{2+}+3H_{2}PO_{4}^{-}+NH_{4}^{+}+6H_{2}O$
(6)$(NH_{4})_{2}SO_{4}$
(7)还原
命题意图:本题以电解锰工业废盐的综合回收为情境,考查工艺流程、沉淀转化、离子方程式书写等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路:废盐溶液加入氨水,通入氧气和$NH_{3}· H_{2}O$进行“沉锰Ⅰ”过滤得到$Mn_{3}O_{4}$,滤液中含有$Mn^{2+}$、$Mg^{2+}$、$NH_{4}^{+}$、$SO_{4}^{2-}$;溶液再加入$(NH_{4})_{2}S_{2}O_{8}$,进行“沉锰Ⅱ”将$Mn^{2+}$转化为$MnO_{2}$;溶液再加入$NH_{4}HCO_{3}$和$NH_{3}· H_{2}O$调节$pH$进行“沉镁Ⅰ”,得到碱式碳酸镁,“煅烧”得到$MgO$;溶液再加入$H_{3}PO_{4}$“沉镁Ⅱ”,得到$MgNH_{4}PO_{4}·6H_{2}O$沉淀;溶液加入$H_{2}SO_{4}$调节$pH = 6.0$,促使$NH_{4}^{+}$和$SO_{4}^{2-}$结合为$(NH_{4})_{2}SO_{4}$晶体析出,最后$(NH_{4})_{2}SO_{4}$与$MnO_{2}$和$Mn_{3}O_{4}$“焙烧”,经过多步处理得到$MnSO_{4}· H_{2}O$。
(2)已知$K_{sp}[Mg(OH)_{2}]>K_{sp}[Mn(OH)_{2}]$,故当$Mg^{2+}$开始沉淀时$Mn^{2+}$已生成沉淀,溶液中$\frac{c(Mg^{2+})}{c(Mn^{2+})}=\frac{K_{sp}[Mg(OH)_{2}]}{K_{sp}[Mn(OH)_{2}]}=\frac{10^{-11.25}}{10^{-12.72}}=10^{1.47}$,则溶液中剩余的$c(Mn^{2+})=\frac{10^{-0.68}}{10^{1.47}}mol· L^{-1}=10^{-2.15}mol· L^{-1}$。
(3)“沉锰Ⅱ”中,过量的$(NH_{4})_{2}S_{2}O_{8}$经热水解去除,$(NH_{4})_{2}S_{2}O_{8}$中存在过氧键,发生水解生成$NH_{4}HSO_{4}$和$H_{2}O_{2}$,化学方程式为$(NH_{4})_{2}S_{2}O_{8}+2H_{2}O\xlongequal{\triangle}2NH_{4}HSO_{4}+H_{2}O_{2}$,$H_{2}O_{2}$受热易分解$2H_{2}O_{2}\xlongequal{\triangle}2H_{2}O+O_{2}\uparrow$,总反应为$2(NH_{4})_{2}S_{2}O_{8}+2H_{2}O\xlongequal{\triangle}4NH_{4}HSO_{4}+O_{2}\uparrow$,最终产物是$NH_{4}HSO_{4}$和$O_{2}$。
(5)由图可知,$pH = 8.0$时,产生的沉淀为$MgNH_{4}PO_{4}·6H_{2}O$,加$H_{3}PO_{4}$调节到$pH = 4.0$,结合分布分数图,此时磷元素的主要存在形式为$H_{2}PO_{4}^{-}$,镁元素的主要存在形式为$Mg^{2+}$。
(7)“焙烧”中,$Mn_{3}O_{4}$和$MnO_{2}$最终生成$MnSO_{4}· H_{2}O$,$Mn$元素化合价降低,发生了还原反应。
(1)搅拌、适当升温(答案合理即可)
(2)$6Mn(OH)_{2}+O_{2}=2Mn_{3}O_{4}+6H_{2}O$ $10^{-2.15}$
(3)$O_{2}$
(4)$pH$过大时,沉淀中$MgCO_{3}$的比例降低,煅烧产生的$CO_{2}$气体减少,不能得到疏松的轻质$MgO$
(5)$MgNH_{4}PO_{4}·6H_{2}O+2H_{3}PO_{4}=Mg^{2+}+3H_{2}PO_{4}^{-}+NH_{4}^{+}+6H_{2}O$
(6)$(NH_{4})_{2}SO_{4}$
(7)还原
命题意图:本题以电解锰工业废盐的综合回收为情境,考查工艺流程、沉淀转化、离子方程式书写等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路:废盐溶液加入氨水,通入氧气和$NH_{3}· H_{2}O$进行“沉锰Ⅰ”过滤得到$Mn_{3}O_{4}$,滤液中含有$Mn^{2+}$、$Mg^{2+}$、$NH_{4}^{+}$、$SO_{4}^{2-}$;溶液再加入$(NH_{4})_{2}S_{2}O_{8}$,进行“沉锰Ⅱ”将$Mn^{2+}$转化为$MnO_{2}$;溶液再加入$NH_{4}HCO_{3}$和$NH_{3}· H_{2}O$调节$pH$进行“沉镁Ⅰ”,得到碱式碳酸镁,“煅烧”得到$MgO$;溶液再加入$H_{3}PO_{4}$“沉镁Ⅱ”,得到$MgNH_{4}PO_{4}·6H_{2}O$沉淀;溶液加入$H_{2}SO_{4}$调节$pH = 6.0$,促使$NH_{4}^{+}$和$SO_{4}^{2-}$结合为$(NH_{4})_{2}SO_{4}$晶体析出,最后$(NH_{4})_{2}SO_{4}$与$MnO_{2}$和$Mn_{3}O_{4}$“焙烧”,经过多步处理得到$MnSO_{4}· H_{2}O$。
(2)已知$K_{sp}[Mg(OH)_{2}]>K_{sp}[Mn(OH)_{2}]$,故当$Mg^{2+}$开始沉淀时$Mn^{2+}$已生成沉淀,溶液中$\frac{c(Mg^{2+})}{c(Mn^{2+})}=\frac{K_{sp}[Mg(OH)_{2}]}{K_{sp}[Mn(OH)_{2}]}=\frac{10^{-11.25}}{10^{-12.72}}=10^{1.47}$,则溶液中剩余的$c(Mn^{2+})=\frac{10^{-0.68}}{10^{1.47}}mol· L^{-1}=10^{-2.15}mol· L^{-1}$。
(3)“沉锰Ⅱ”中,过量的$(NH_{4})_{2}S_{2}O_{8}$经热水解去除,$(NH_{4})_{2}S_{2}O_{8}$中存在过氧键,发生水解生成$NH_{4}HSO_{4}$和$H_{2}O_{2}$,化学方程式为$(NH_{4})_{2}S_{2}O_{8}+2H_{2}O\xlongequal{\triangle}2NH_{4}HSO_{4}+H_{2}O_{2}$,$H_{2}O_{2}$受热易分解$2H_{2}O_{2}\xlongequal{\triangle}2H_{2}O+O_{2}\uparrow$,总反应为$2(NH_{4})_{2}S_{2}O_{8}+2H_{2}O\xlongequal{\triangle}4NH_{4}HSO_{4}+O_{2}\uparrow$,最终产物是$NH_{4}HSO_{4}$和$O_{2}$。
(5)由图可知,$pH = 8.0$时,产生的沉淀为$MgNH_{4}PO_{4}·6H_{2}O$,加$H_{3}PO_{4}$调节到$pH = 4.0$,结合分布分数图,此时磷元素的主要存在形式为$H_{2}PO_{4}^{-}$,镁元素的主要存在形式为$Mg^{2+}$。
(7)“焙烧”中,$Mn_{3}O_{4}$和$MnO_{2}$最终生成$MnSO_{4}· H_{2}O$,$Mn$元素化合价降低,发生了还原反应。
查看更多完整答案,请扫码查看


