2026年新高考5年真题高中化学全一册通用版广东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题高中化学全一册通用版广东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第58页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
2. [2025·北京卷,19T,11分]化学反应平衡常数对认识化学反应的方向和限度具有指导意义。实验小组研究测定“$ MnO_2 + 2 Br^- + 4 H^+ \rightleftharpoons Mn^{2+} + Br_2 + 2 H_2 O$”平衡常数的方法,对照理论数据判断方法的可行性。
(1)理论分析
①$ Br_2$易挥发,需控制生成$c( Br_2)$较小。
②根据$25\ ° C$时$K = 6.3 × 10^4$分析,控制合适pH,可使生成$c( Br_2)$较小;用浓度较大的$ KBr$溶液与过量$ MnO_2$反应,反应前后$c( Br^-)$几乎不变;$c( Mn^{2+}) = c( Br_2)$,仅需测定平衡时溶液pH和$c( Br_2)$。
③$ Br_2$与水反应的程度很小,可忽略对测定干扰;低浓度$ HBr$挥发性很小,可忽略。
(2)实验探究

已知:$ I_2 + 2 Na_2 S_2 O_3 \longrightarrow 2 NaI + Na_2 S_4 O_6$;$ Na_2 S_2 O_3$和$ Na_2 S_4 O_6$溶液颜色均为无色。
①Ⅲ中,滴定时选用淀粉作指示剂,滴定终点时的现象是
②Ⅰ中,与反应前的溶液相比,反应后溶液的pH
③Ⅱ中,按$\frac{c( Mn^{2+}) · c( Br_2)}{c^2( Br^-) · c^4( H^+)}$计算所得值也小于$25\ ° C$的$K$值,可能原因是
(3)实验改进
分析实验Ⅰ、Ⅱ中测定结果均偏小的原因,改变实验条件,再次实验。控制反应温度为$40\ ° C$,其他条件与Ⅱ相同,经实验准确测得该条件下的平衡常数。
①判断该实验测得的平衡常数是否准确,应与
②综合调控pH和温度的目的是
(1)理论分析
①$ Br_2$易挥发,需控制生成$c( Br_2)$较小。
②根据$25\ ° C$时$K = 6.3 × 10^4$分析,控制合适pH,可使生成$c( Br_2)$较小;用浓度较大的$ KBr$溶液与过量$ MnO_2$反应,反应前后$c( Br^-)$几乎不变;$c( Mn^{2+}) = c( Br_2)$,仅需测定平衡时溶液pH和$c( Br_2)$。
③$ Br_2$与水反应的程度很小,可忽略对测定干扰;低浓度$ HBr$挥发性很小,可忽略。
(2)实验探究

已知:$ I_2 + 2 Na_2 S_2 O_3 \longrightarrow 2 NaI + Na_2 S_4 O_6$;$ Na_2 S_2 O_3$和$ Na_2 S_4 O_6$溶液颜色均为无色。
①Ⅲ中,滴定时选用淀粉作指示剂,滴定终点时的现象是
滴入最后半滴 $\mathrm{Na_2S_2O_3}$ 标准溶液,溶液恰好由蓝色变为无色,且半分钟内不恢复蓝色
。用离子方程式表示KI的作用:$\mathrm{Br_2 + 2I^- = 2Br^- + I_2}$
。②Ⅰ中,与反应前的溶液相比,反应后溶液的pH
增大
(填“增大”“减小”或“不变”)。平衡后,按$\frac{c( Mn^{2+}) · c( Br_2)}{c^2( Br^-) · c^4( H^+)}$计算所得值小于$25\ ° C$的$K$值,是因为$ Br_2$挥发导致计算时所用$\mathrm{Mn^{2+}}$
的浓度小于其在溶液中实际浓度。③Ⅱ中,按$\frac{c( Mn^{2+}) · c( Br_2)}{c^2( Br^-) · c^4( H^+)}$计算所得值也小于$25\ ° C$的$K$值,可能原因是
实验Ⅱ的 $c(\mathrm{H^+})$ 浓度低于实验Ⅰ,反应相同时间下,实验Ⅱ未达到平衡状态
。(3)实验改进
分析实验Ⅰ、Ⅱ中测定结果均偏小的原因,改变实验条件,再次实验。控制反应温度为$40\ ° C$,其他条件与Ⅱ相同,经实验准确测得该条件下的平衡常数。
①判断该实验测得的平衡常数是否准确,应与
$40\ \mathrm{° C}$ 时的理论平衡常数 $K$
值比较。②综合调控pH和温度的目的是
调节温度使反应更快的达到平衡状态,调节 $\mathrm{pH}$ 使生成 $c(\mathrm{Br_2})$ 较小,$\mathrm{Br_2}$ 处于溶解平衡且挥发最少的状态,从而准确测定 $K$ 值
。
答案:
2.参考答案
(2)①滴入最后半滴 $\mathrm{Na_2S_2O_3}$ 标准溶液,溶液恰好由蓝色变为无色,且半分钟内不恢复蓝色 $\mathrm{Br_2 + 2I^- = 2Br^- + I_2}$ ②增大 $\mathrm{Mn^{2+}}$ ③实验Ⅱ的 $c(\mathrm{H^+})$ 浓度低于实验Ⅰ,反应相同时间下,实验Ⅱ未达到平衡状态
(3)①$40\ \mathrm{° C}$ 时的理论平衡常数 $K$ ②调节温度使反应更快的达到平衡状态,调节 $\mathrm{pH}$ 使生成 $c(\mathrm{Br_2})$ 较小,$\mathrm{Br_2}$ 处于溶解平衡且挥发最少的状态,从而准确测定 $K$ 值
命题意图 本题通过平衡常数测定的定量实验,综合考查化学反应速率与平衡,涉及滴定原理、误差分析及实验条件的调控,体现了“科学探究与创新意识”“证据推理与模型认知”等化学学科核心素养。
解题思路
(2)①淀粉遇 $\mathrm{I_2}$ 显蓝色,$\mathrm{I_2}$ 与 $\mathrm{Na_2S_2O_3}$ 完全反应后蓝色消失,故滴定终点现象为滴入最后半滴 $\mathrm{Na_2S_2O_3}$ 标准溶液,溶液恰好由蓝色变为无色,且半分钟内不恢复蓝色。$\mathrm{KI}$ 的作用为将 $\mathrm{Br_2}$ 转化为 $\mathrm{I_2}$,便于滴定测定 $\mathrm{Br_2}$ 浓度。②该反应消耗 $\mathrm{H^+}$ 生成水,反应后溶液 $\mathrm{pH}$ 增大。因为 $\mathrm{Br_2}$ 挥发导致溶液中 $c(\mathrm{Br_2})$ 偏小,此时溶液中 $c(\mathrm{Br_2})<c(\mathrm{Mn^{2+}})$,则利用 $c(\mathrm{Mn^{2+}})=c(\mathrm{Br_2})$ 计算时,所用 $c(\mathrm{Mn^{2+}})$ 的浓度小于其在溶液中实际浓度。③实验Ⅱ液面上方未观察到黄色气体,说明实验Ⅱ中 $\mathrm{Br_2}$ 未挥发,结合已知信息 $\mathrm{Br_2}$ 与水反应的程度很小,可忽略对测定干扰;低浓度 $\mathrm{HBr}$ 挥发性很小,可忽略。对比实验Ⅰ和Ⅱ可知,实验Ⅰ、Ⅱ反应相同时间,实验Ⅱ $\mathrm{pH}$ 更大,$c(\mathrm{H^+})$ 更小且反应后溶液为淡黄色,则可能原因是实验Ⅱ的 $c(\mathrm{H^+})$ 低于实验Ⅰ的 $c(\mathrm{H^+})$,反应相同时间下,实验Ⅱ未达到平衡状态,导致溶液中 $c(\mathrm{Mn^{2+}})$、$c(\mathrm{Br_2})$ 偏低,计算的 $K$ 值偏小。
(3)①平衡常数会受温度的影响而发生改变,则验证平衡常数的准确性应与 $40\ \mathrm{° C}$ 时的理论 $K$ 值比较。②实验Ⅰ和实验Ⅱ反应时间相同,实验Ⅰ由于 $c(\mathrm{H^+})$ 较大,反应速率快,$\mathrm{Br_2}$ 挥发导致计算的 $K$ 值小。实验Ⅱ由于 $c(\mathrm{H^+})$ 较小,反应速率较慢,反应相同时间未达平衡状态,导致计算的 $K$ 值小。故调控温度的目的为使反应更快达到平衡状态,调控 $\mathrm{pH}$ 的目的为使 $\mathrm{Br_2}$ 处于溶解平衡且挥发最少的状态,从而准确测定 $K$ 值。
(2)①滴入最后半滴 $\mathrm{Na_2S_2O_3}$ 标准溶液,溶液恰好由蓝色变为无色,且半分钟内不恢复蓝色 $\mathrm{Br_2 + 2I^- = 2Br^- + I_2}$ ②增大 $\mathrm{Mn^{2+}}$ ③实验Ⅱ的 $c(\mathrm{H^+})$ 浓度低于实验Ⅰ,反应相同时间下,实验Ⅱ未达到平衡状态
(3)①$40\ \mathrm{° C}$ 时的理论平衡常数 $K$ ②调节温度使反应更快的达到平衡状态,调节 $\mathrm{pH}$ 使生成 $c(\mathrm{Br_2})$ 较小,$\mathrm{Br_2}$ 处于溶解平衡且挥发最少的状态,从而准确测定 $K$ 值
命题意图 本题通过平衡常数测定的定量实验,综合考查化学反应速率与平衡,涉及滴定原理、误差分析及实验条件的调控,体现了“科学探究与创新意识”“证据推理与模型认知”等化学学科核心素养。
解题思路
(2)①淀粉遇 $\mathrm{I_2}$ 显蓝色,$\mathrm{I_2}$ 与 $\mathrm{Na_2S_2O_3}$ 完全反应后蓝色消失,故滴定终点现象为滴入最后半滴 $\mathrm{Na_2S_2O_3}$ 标准溶液,溶液恰好由蓝色变为无色,且半分钟内不恢复蓝色。$\mathrm{KI}$ 的作用为将 $\mathrm{Br_2}$ 转化为 $\mathrm{I_2}$,便于滴定测定 $\mathrm{Br_2}$ 浓度。②该反应消耗 $\mathrm{H^+}$ 生成水,反应后溶液 $\mathrm{pH}$ 增大。因为 $\mathrm{Br_2}$ 挥发导致溶液中 $c(\mathrm{Br_2})$ 偏小,此时溶液中 $c(\mathrm{Br_2})<c(\mathrm{Mn^{2+}})$,则利用 $c(\mathrm{Mn^{2+}})=c(\mathrm{Br_2})$ 计算时,所用 $c(\mathrm{Mn^{2+}})$ 的浓度小于其在溶液中实际浓度。③实验Ⅱ液面上方未观察到黄色气体,说明实验Ⅱ中 $\mathrm{Br_2}$ 未挥发,结合已知信息 $\mathrm{Br_2}$ 与水反应的程度很小,可忽略对测定干扰;低浓度 $\mathrm{HBr}$ 挥发性很小,可忽略。对比实验Ⅰ和Ⅱ可知,实验Ⅰ、Ⅱ反应相同时间,实验Ⅱ $\mathrm{pH}$ 更大,$c(\mathrm{H^+})$ 更小且反应后溶液为淡黄色,则可能原因是实验Ⅱ的 $c(\mathrm{H^+})$ 低于实验Ⅰ的 $c(\mathrm{H^+})$,反应相同时间下,实验Ⅱ未达到平衡状态,导致溶液中 $c(\mathrm{Mn^{2+}})$、$c(\mathrm{Br_2})$ 偏低,计算的 $K$ 值偏小。
(3)①平衡常数会受温度的影响而发生改变,则验证平衡常数的准确性应与 $40\ \mathrm{° C}$ 时的理论 $K$ 值比较。②实验Ⅰ和实验Ⅱ反应时间相同,实验Ⅰ由于 $c(\mathrm{H^+})$ 较大,反应速率快,$\mathrm{Br_2}$ 挥发导致计算的 $K$ 值小。实验Ⅱ由于 $c(\mathrm{H^+})$ 较小,反应速率较慢,反应相同时间未达平衡状态,导致计算的 $K$ 值小。故调控温度的目的为使反应更快达到平衡状态,调控 $\mathrm{pH}$ 的目的为使 $\mathrm{Br_2}$ 处于溶解平衡且挥发最少的状态,从而准确测定 $K$ 值。
3. [2025·江苏卷,16T,15分]海洋出水铁质文物表面有凝结物,研究其形成原理和脱氯方法对保护文物意义重大。
(1)文物出水清淤后,须尽快浸泡在稀$ NaOH$或$ Na_2 CO_3$溶液中进行现场保护。
①玻璃中的$ SiO_2$能与$ NaOH$反应生成
②文物浸泡在碱性溶液中比暴露在空气中能减缓吸氧腐蚀,其原因有
(2)文物表面凝结物种类受文物材质和海洋环境等因素的影响。
①无氧环境中,文物中的Fe与海水中的$ SO_4^{2-}$在细菌作用下形成FeS等含铁凝结物。写出Fe与$ SO_4^{2-}$反应生成FeS和$ Fe(OH)_2$的离子方程式:
②有氧环境中,海水中的铁质文物表面形成$ FeOOH$等凝结物。
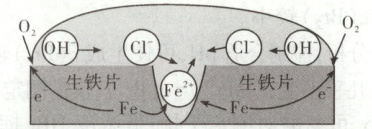
(i)铁在盐水中腐蚀的可能机理如图所示。依据原理设计如下实验:向$ NaCl$溶液中加入$ K_3[ Fe(CN)_6]$溶液(能与$ Fe^{2+}$形成蓝色沉淀)和酚酞,将混合液滴到生铁片上。预测该实验的现象为
(ii)铁的氢氧化物吸附某些阳离子形成带正电的胶粒,是凝结物富集$ Cl^-$的可能原因。该胶粒的形成过程中,参与的主要阳离子有
(3)为比较含氯$ FeOOH$在$ NaOH$溶液与蒸馏水中浸泡的脱氯效果,请补充实验方案:取一定量含氯$ FeOOH$模拟样品,将其分为两等份,
(1)文物出水清淤后,须尽快浸泡在稀$ NaOH$或$ Na_2 CO_3$溶液中进行现场保护。
①玻璃中的$ SiO_2$能与$ NaOH$反应生成
$\mathrm{Na_2SiO_3}$
(填化学式),故不能使用带磨口玻璃塞的试剂瓶盛放$ NaOH$溶液。②文物浸泡在碱性溶液中比暴露在空气中能减缓吸氧腐蚀,其原因有
碱性环境抑制吸氧腐蚀正极电极反应 $\mathrm{O_2 + 2H_2O + 4e^- = 4OH^-}$ 的正向进行,反应速率减慢;碱性溶液中 $\mathrm{O_2}$ 浓度更低
。(2)文物表面凝结物种类受文物材质和海洋环境等因素的影响。
①无氧环境中,文物中的Fe与海水中的$ SO_4^{2-}$在细菌作用下形成FeS等含铁凝结物。写出Fe与$ SO_4^{2-}$反应生成FeS和$ Fe(OH)_2$的离子方程式:
$\mathrm{4Fe + SO_4^{2-} + 4H_2O\xlongequal{细菌}FeS + 3Fe(OH)_2 + 2OH^-}$
。②有氧环境中,海水中的铁质文物表面形成$ FeOOH$等凝结物。
(i)铁在盐水中腐蚀的可能机理如图所示。依据原理设计如下实验:向$ NaCl$溶液中加入$ K_3[ Fe(CN)_6]$溶液(能与$ Fe^{2+}$形成蓝色沉淀)和酚酞,将混合液滴到生铁片上。预测该实验的现象为
滴加混合溶液后,液滴中心出现蓝色沉淀,边缘呈红色
。
(ii)铁的氢氧化物吸附某些阳离子形成带正电的胶粒,是凝结物富集$ Cl^-$的可能原因。该胶粒的形成过程中,参与的主要阳离子有
$\mathrm{Fe^{3+}}$、$\mathrm{Fe^{2+}}$
(填离子符号)。(3)为比较含氯$ FeOOH$在$ NaOH$溶液与蒸馏水中浸泡的脱氯效果,请补充实验方案:取一定量含氯$ FeOOH$模拟样品,将其分为两等份,
在室温下分别加入 $5\ \mathrm{mL}$ 的 $0.5\ \mathrm{mol· L^{-1}}\ \mathrm{NaOH}$ 溶液和 $5\ \mathrm{mL}$ 蒸馏水浸泡 $30\ \mathrm{min}$;过滤,取 $2\ \mathrm{mL}$ 上清液置于两支小试管中,分别滴加 $3\ \mathrm{mL}\ 0.5\ \mathrm{mol· L^{-1}}\ \mathrm{HNO_3}$ 溶液酸化,再分别逐滴加入 $0.05\ \mathrm{mol· L^{-1}}\ \mathrm{AgNO_3}$ 溶液。记录每份上清液开始出现白色沉淀时消耗 $\mathrm{AgNO_3}$ 溶液的体积
。比较滴加$ AgNO_3$溶液体积[$K_{sp}( AgCl) = 1.8 × 10^{-10}$]。实验须遵循节约试剂用量的原则,必须使用的试剂:蒸馏水、$0.5\ mol· L^{-1} NaOH$溶液、$0.5\ mol· L^{-1} HNO_3$溶液、$0.05\ mol· L^{-1} AgNO_3$溶液。
答案:
3.参考答案
(1)$\mathrm{Na_2SiO_3}$ ②碱性环境抑制吸氧腐蚀正极电极反应 $\mathrm{O_2 + 2H_2O + 4e^- = 4OH^-}$ 的正向进行,反应速率减慢;碱性溶液中 $\mathrm{O_2}$ 浓度更低
(2)①$\mathrm{4Fe + SO_4^{2-} + 4H_2O\xlongequal{细菌}FeS + 3Fe(OH)_2 + 2OH^-}$ ②(ⅰ)滴加混合溶液后,液滴中心出现蓝色沉淀,边缘呈红色 (ⅱ)$\mathrm{Fe^{3+}}$、$\mathrm{Fe^{2+}}$
(3)在室温下分别加入 $5\ \mathrm{mL}$ 的 $0.5\ \mathrm{mol· L^{-1}}\ \mathrm{NaOH}$ 溶液和 $5\ \mathrm{mL}$ 蒸馏水浸泡 $30\ \mathrm{min}$;过滤,取 $2\ \mathrm{mL}$ 上清液置于两支小试管中,分别滴加 $3\ \mathrm{mL}\ 0.5\ \mathrm{mol· L^{-1}}\ \mathrm{HNO_3}$ 溶液酸化,再分别逐滴加入 $0.05\ \mathrm{mol· L^{-1}}\ \mathrm{AgNO_3}$ 溶液。记录每份上清液开始出现白色沉淀时消耗 $\mathrm{AgNO_3}$ 溶液的体积
命题意图 本题聚焦海洋出水铁质文物,考查金属的腐蚀与防护、物质性质及氯离子的定量分析,体现了“科学探究与创新意识”“科学态度与社会责任”等化学学科核心素养。
解题思路
(1)②文物发生吸氧腐蚀时正极电极反应为 $\mathrm{O_2 + 4e^- + 2H_2O = 4OH^-}$,根据化学平衡移动原理,碱性溶液中 $\mathrm{OH^-}$ 浓度较大,会抑制 $\mathrm{O_2}$ 得电子,使吸氧腐蚀的速率减慢。相比空气,碱性溶液中溶解的 $\mathrm{O_2}$ 较少,浓度较低,减少了文物与 $\mathrm{O_2}$ 的接触,减缓吸氧腐蚀。
(2)②(ⅰ)由题图知,铁片在 $\mathrm{NaCl}$ 溶液中发生吸氧腐蚀,开始时,负极电极反应为 $\mathrm{Fe - 2e^- = Fe^{2+}}$,正极电极反应为 $\mathrm{O_2 + 4e^- + 2H_2O = 4OH^-}$。$\mathrm{Fe^{2+}}$ 与 $\mathrm{K_3[Fe(CN)_6]}$ 反应生成 $\mathrm{KFe[Fe(CN)_6]}$ 蓝色沉淀,结合图示,$\mathrm{Fe^{2+}}$ 向生铁片中心移动,铁片上液滴中心会出现蓝色。溶液中酚酞遇到 $\mathrm{OH^-}$ 变红,结合图示,在生铁片、空气和溶液的接触面处 $\mathrm{O_2}$ 得电子转化为 $\mathrm{OH^-}$,故铁片上液滴边缘会出现红色。(ⅱ)铁片发生吸氧腐蚀,负极区生成 $\mathrm{Fe^{2+}}$ 被 $\mathrm{O_2}$ 进一步氧化为 $\mathrm{Fe^{3+}}$,此时体系中参与胶状形成的阳离子主要有 $\mathrm{Fe^{2+}}$、$\mathrm{Fe^{3+}}$。
(3)要检验脱氯效果,应控制样品用量、脱氯时间、取用体积等变量相同,利用 $\mathrm{Ag^+}$ 与 $\mathrm{Cl^-}$ 的反应进行沉淀滴定实验。实验中,首先需要将等量的含氯 $\mathrm{FeOOH}$ 模拟样品分别用等体积的 $\mathrm{NaOH}$ 溶液与蒸馏水浸泡脱氯,然后取等体积的两种上清液,先用 $\mathrm{HNO_3}$ 溶液酸化,再加入 $\mathrm{AgNO_3}$ 溶液,由于两溶液中含 $\mathrm{Cl^-}$ 浓度不同,故开始出现 $\mathrm{AgCl}$ 白色沉淀所消耗的 $\mathrm{AgNO_3}$ 溶液的量不同,通过比较刚开始出现白色沉淀时消耗 $\mathrm{AgNO_3}$ 溶液体积的大小,即可比较脱氯效果。
(1)$\mathrm{Na_2SiO_3}$ ②碱性环境抑制吸氧腐蚀正极电极反应 $\mathrm{O_2 + 2H_2O + 4e^- = 4OH^-}$ 的正向进行,反应速率减慢;碱性溶液中 $\mathrm{O_2}$ 浓度更低
(2)①$\mathrm{4Fe + SO_4^{2-} + 4H_2O\xlongequal{细菌}FeS + 3Fe(OH)_2 + 2OH^-}$ ②(ⅰ)滴加混合溶液后,液滴中心出现蓝色沉淀,边缘呈红色 (ⅱ)$\mathrm{Fe^{3+}}$、$\mathrm{Fe^{2+}}$
(3)在室温下分别加入 $5\ \mathrm{mL}$ 的 $0.5\ \mathrm{mol· L^{-1}}\ \mathrm{NaOH}$ 溶液和 $5\ \mathrm{mL}$ 蒸馏水浸泡 $30\ \mathrm{min}$;过滤,取 $2\ \mathrm{mL}$ 上清液置于两支小试管中,分别滴加 $3\ \mathrm{mL}\ 0.5\ \mathrm{mol· L^{-1}}\ \mathrm{HNO_3}$ 溶液酸化,再分别逐滴加入 $0.05\ \mathrm{mol· L^{-1}}\ \mathrm{AgNO_3}$ 溶液。记录每份上清液开始出现白色沉淀时消耗 $\mathrm{AgNO_3}$ 溶液的体积
命题意图 本题聚焦海洋出水铁质文物,考查金属的腐蚀与防护、物质性质及氯离子的定量分析,体现了“科学探究与创新意识”“科学态度与社会责任”等化学学科核心素养。
解题思路
(1)②文物发生吸氧腐蚀时正极电极反应为 $\mathrm{O_2 + 4e^- + 2H_2O = 4OH^-}$,根据化学平衡移动原理,碱性溶液中 $\mathrm{OH^-}$ 浓度较大,会抑制 $\mathrm{O_2}$ 得电子,使吸氧腐蚀的速率减慢。相比空气,碱性溶液中溶解的 $\mathrm{O_2}$ 较少,浓度较低,减少了文物与 $\mathrm{O_2}$ 的接触,减缓吸氧腐蚀。
(2)②(ⅰ)由题图知,铁片在 $\mathrm{NaCl}$ 溶液中发生吸氧腐蚀,开始时,负极电极反应为 $\mathrm{Fe - 2e^- = Fe^{2+}}$,正极电极反应为 $\mathrm{O_2 + 4e^- + 2H_2O = 4OH^-}$。$\mathrm{Fe^{2+}}$ 与 $\mathrm{K_3[Fe(CN)_6]}$ 反应生成 $\mathrm{KFe[Fe(CN)_6]}$ 蓝色沉淀,结合图示,$\mathrm{Fe^{2+}}$ 向生铁片中心移动,铁片上液滴中心会出现蓝色。溶液中酚酞遇到 $\mathrm{OH^-}$ 变红,结合图示,在生铁片、空气和溶液的接触面处 $\mathrm{O_2}$ 得电子转化为 $\mathrm{OH^-}$,故铁片上液滴边缘会出现红色。(ⅱ)铁片发生吸氧腐蚀,负极区生成 $\mathrm{Fe^{2+}}$ 被 $\mathrm{O_2}$ 进一步氧化为 $\mathrm{Fe^{3+}}$,此时体系中参与胶状形成的阳离子主要有 $\mathrm{Fe^{2+}}$、$\mathrm{Fe^{3+}}$。
(3)要检验脱氯效果,应控制样品用量、脱氯时间、取用体积等变量相同,利用 $\mathrm{Ag^+}$ 与 $\mathrm{Cl^-}$ 的反应进行沉淀滴定实验。实验中,首先需要将等量的含氯 $\mathrm{FeOOH}$ 模拟样品分别用等体积的 $\mathrm{NaOH}$ 溶液与蒸馏水浸泡脱氯,然后取等体积的两种上清液,先用 $\mathrm{HNO_3}$ 溶液酸化,再加入 $\mathrm{AgNO_3}$ 溶液,由于两溶液中含 $\mathrm{Cl^-}$ 浓度不同,故开始出现 $\mathrm{AgCl}$ 白色沉淀所消耗的 $\mathrm{AgNO_3}$ 溶液的量不同,通过比较刚开始出现白色沉淀时消耗 $\mathrm{AgNO_3}$ 溶液体积的大小,即可比较脱氯效果。
查看更多完整答案,请扫码查看


