第80页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
12. 某化学兴趣小组在实验室中取一定量的过氧化氢溶液放入小烧杯中并加入少量的二氧化锰,用电子秤测其质量,不同时间电子秤的读数记录如表所示。
|时间/min|0|1|2|3|4|5|
|----|----|----|----|----|----|----|
|电子秤示数|205g|203.4g|201.8g|200.2g|198.6g|198.6g|
(1)通过对上述表格的分析,该化学反应生成氧气的质量为____g。
(2)计算此过氧化氢溶液中含过氧化氢的质量,写出计算过程(不考虑水的蒸发,结果精确到0.1)。
|时间/min|0|1|2|3|4|5|
|----|----|----|----|----|----|----|
|电子秤示数|205g|203.4g|201.8g|200.2g|198.6g|198.6g|
(1)通过对上述表格的分析,该化学反应生成氧气的质量为____g。
(2)计算此过氧化氢溶液中含过氧化氢的质量,写出计算过程(不考虑水的蒸发,结果精确到0.1)。
答案:
解:
(1)6.4
(2)设溶液中过氧化氢的质量为x,则
2H₂O₂$\xlongequal{MnO₂}$2H₂O + O₂↑
68 32
x 6.4g
$\frac{68}{32}$ = $\frac{x}{6.4g}$
x = 13.6g
答:该过氧化氢溶液中过氧化氢的质量是13.6g。
(1)6.4
(2)设溶液中过氧化氢的质量为x,则
2H₂O₂$\xlongequal{MnO₂}$2H₂O + O₂↑
68 32
x 6.4g
$\frac{68}{32}$ = $\frac{x}{6.4g}$
x = 13.6g
答:该过氧化氢溶液中过氧化氢的质量是13.6g。
13. 2025天津南开区期末 “化学氧自救呼吸器”是人在缺氧环境或出现高浓度有毒有害气体环境中使用的一种安全防护装置。制氧剂的主要成分是超氧化钾(KO_2),反应原理为$4KO_2+mCO_2\xlongequal{}mK_2CO_3+3O_2。$计算:
(1)m的值为____。
(2)同学查阅资料得知人每小时约呼出二氧化碳44g,若“化学氧自救呼吸器”中KO_2的质量为142g,则理论上该“化学氧自救呼吸器”可使用____小时。
(3)若要制得96g氧气,求理论上需要含超氧化钾80%的制氧剂的质量。
(1)m的值为____。
(2)同学查阅资料得知人每小时约呼出二氧化碳44g,若“化学氧自救呼吸器”中KO_2的质量为142g,则理论上该“化学氧自救呼吸器”可使用____小时。
(3)若要制得96g氧气,求理论上需要含超氧化钾80%的制氧剂的质量。
答案:
解:
(1)2
(2)1
(3)设理论上需要含超氧化钾80%的制氧剂的质量为y。
4KO₂ + 2CO₂ = 2K₂CO₃ + 3O₂
284 96
y×80% 96g
$\frac{284}{96}$ = $\frac{y×80\%}{96g}$
y = 355g
答:若要制得96g氧气,理论上需要含超氧化钾80%的制氧剂的质量为355g。
点拨:
(2)设142gKO₂消耗二氧化碳的质量为x。
4KO₂ + 2CO₂ = 2K₂CO₃ + 3O₂
284 88
142g x
$\frac{284}{88}$ = $\frac{142g}{x}$
x = 44g
由同学查阅资料得知人每小时约呼出二氧化碳44g,若“化学氧自救呼吸器”中KO₂的质量为142g,则理论上该“化学氧自救呼吸器”可使用1小时。
(1)2
(2)1
(3)设理论上需要含超氧化钾80%的制氧剂的质量为y。
4KO₂ + 2CO₂ = 2K₂CO₃ + 3O₂
284 96
y×80% 96g
$\frac{284}{96}$ = $\frac{y×80\%}{96g}$
y = 355g
答:若要制得96g氧气,理论上需要含超氧化钾80%的制氧剂的质量为355g。
点拨:
(2)设142gKO₂消耗二氧化碳的质量为x。
4KO₂ + 2CO₂ = 2K₂CO₃ + 3O₂
284 88
142g x
$\frac{284}{88}$ = $\frac{142g}{x}$
x = 44g
由同学查阅资料得知人每小时约呼出二氧化碳44g,若“化学氧自救呼吸器”中KO₂的质量为142g,则理论上该“化学氧自救呼吸器”可使用1小时。
14. 羰基铁粉在国防军工领域有重要应用,我国是少数几个掌握其生产技术的国家之一。制备羰基铁粉的过程如图1所示。
(1)Fe(CO)_5中碳、氧元素的质量比为____。
(2)反应1的化学方程式为$Fe+5CO\xlongequal{高温}Fe(CO)_5。$用100kg含铁96%的海绵铁,理论上可制备Fe(CO)_5的质量是多少?(写出计算过程)
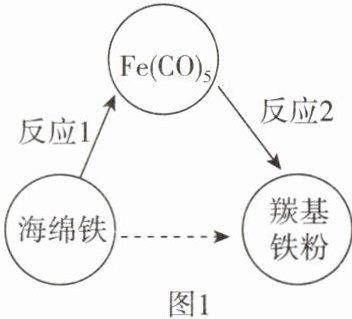
(3)反应2的化学方程式为$Fe(CO)_5\xlongequal{一定条件}Fe+5CO↑。$196kgFe(CO)_5分解生成羰基铁粉的质量随时间的变化如图2所示。在t_1h时,剩余____kg

Fe(CO)_5未分解;在____时Fe(CO)_5恰好完全分解。
(4)制备羰基铁粉过程中循环利用的物质是____。
(1)Fe(CO)_5中碳、氧元素的质量比为____。
(2)反应1的化学方程式为$Fe+5CO\xlongequal{高温}Fe(CO)_5。$用100kg含铁96%的海绵铁,理论上可制备Fe(CO)_5的质量是多少?(写出计算过程)

(3)反应2的化学方程式为$Fe(CO)_5\xlongequal{一定条件}Fe+5CO↑。$196kgFe(CO)_5分解生成羰基铁粉的质量随时间的变化如图2所示。在t_1h时,剩余____kg

Fe(CO)_5未分解;在____时Fe(CO)_5恰好完全分解。
(4)制备羰基铁粉过程中循环利用的物质是____。
答案:
解:
(1)3:4
(2)设理论上可制备Fe(CO)₅的质量是x。
Fe + 5CO$\xlongequal{高温}$Fe(CO)₅
56 196
100kg×96% x
$\frac{56}{196}$ = $\frac{100kg×96\%}{x}$
x = 336kg
答:理论上可制备Fe(CO)₅的质量是336kg。
(3)98;t₃h
(4)CO
点拨:
(1)Fe(CO)₅中碳、氧元素的质量比为(12×5):(16×5) = 3:4。
(3)由题图2知,在t₁h时,生成羰基铁粉的质量为28kg,设t₁h时反应的Fe(CO)₅的质量为y。
Fe(CO)₅$\xlongequal{一定条件}$Fe + 5CO↑
196 56
y 28kg
$\frac{196}{56}$ = $\frac{y}{28kg}$
y = 98kg
则剩余未分解的Fe(CO)₅的质量为196kg - 98kg = 98kg。
(4)由反应1、2的化学方程式可知,制备羰基铁粉过程中循环利用的物质是CO。
(1)3:4
(2)设理论上可制备Fe(CO)₅的质量是x。
Fe + 5CO$\xlongequal{高温}$Fe(CO)₅
56 196
100kg×96% x
$\frac{56}{196}$ = $\frac{100kg×96\%}{x}$
x = 336kg
答:理论上可制备Fe(CO)₅的质量是336kg。
(3)98;t₃h
(4)CO
点拨:
(1)Fe(CO)₅中碳、氧元素的质量比为(12×5):(16×5) = 3:4。
(3)由题图2知,在t₁h时,生成羰基铁粉的质量为28kg,设t₁h时反应的Fe(CO)₅的质量为y。
Fe(CO)₅$\xlongequal{一定条件}$Fe + 5CO↑
196 56
y 28kg
$\frac{196}{56}$ = $\frac{y}{28kg}$
y = 98kg
则剩余未分解的Fe(CO)₅的质量为196kg - 98kg = 98kg。
(4)由反应1、2的化学方程式可知,制备羰基铁粉过程中循环利用的物质是CO。
查看更多完整答案,请扫码查看


