第43页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
9. 一副用元素符号写的春联,上联:Ag、Zn、Na、F、Ga、Hf、Mg(迎新纳福家和美),下联:Re、Sg、Tc、Au、As、Sc、Ti(来喜得金身康泰)。下列说法正确的是()
A. F 位于元素周期表的左侧
B. Na、F 在同一周期
C. Ag、Zn 均为金属元素
D. Na 是地壳中含量最多的元素
A. F 位于元素周期表的左侧
B. Na、F 在同一周期
C. Ag、Zn 均为金属元素
D. Na 是地壳中含量最多的元素
答案:
C
10. 图 1 是两种元素在元素周期表中的信息,图 2 是氟元素的原子结构示意图。下列说法正确的是()
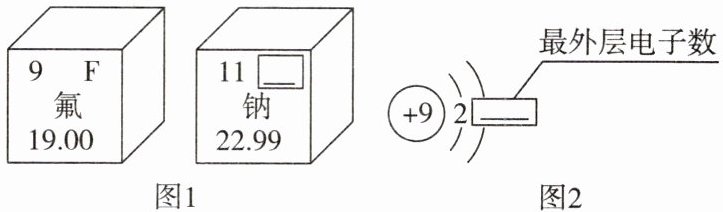
A. 图 1“钠”右上角方框横线上应填写 NA
B. 图 2 方框横线上的数字是 8
C. 氟元素属于稀有气体元素
D. 钠原子易失去最外层电子

A. 图 1“钠”右上角方框横线上应填写 NA
B. 图 2 方框横线上的数字是 8
C. 氟元素属于稀有气体元素
D. 钠原子易失去最外层电子
答案:
D
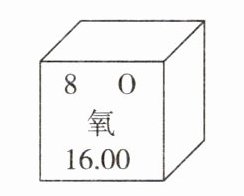
11. 如图是氧元素以及元素周期表一部分的相关信息,下列说法正确的是()
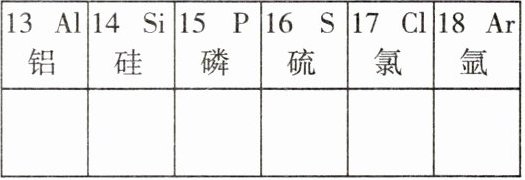
A. 12 号元素的离子符号是 $ Mg^{+2} $
B. 氯原子的核外电子排布是
C. 氧和硫的相对原子质量都是 16.00
D. 钙元素的相对原子质量为 20



A. 12 号元素的离子符号是 $ Mg^{+2} $
B. 氯原子的核外电子排布是
C. 氧和硫的相对原子质量都是 16.00
D. 钙元素的相对原子质量为 20
答案:
B
12. 元素周期表是学习和研究化学的重要工具,如图是元素周期表的一部分,其中 X、Y、Z 代表前三周期三种不同的元素。下列说法中不正确的是()
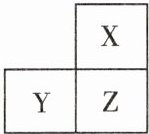
A. 原子序数:$ Y < Z $
B. 最外层电子数:$ X = Z $
C. Y 和 Z 同周期
D. X 和 Z 同族

A. 原子序数:$ Y < Z $
B. 最外层电子数:$ X = Z $
C. Y 和 Z 同周期
D. X 和 Z 同族
答案:
B 点拨:元素周期表中元素是按原子序数依次增大的顺序排列的,原子序数:$Y\lt Z$,A正确;X、Z位于同一族,当X为He时,最外层电子数为2,则Z为Ne,最外层电子数为8,它们的最外层电子数不相同,B错误;元素周期表中同一横行的元素,位于同一周期,则Y和Z同周期,C正确;元素周期表中同一纵列的元素,位于同一族,则X和Z同族,D正确。
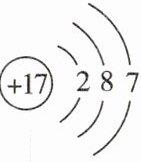
13. 核电荷数为 1~18 的元素的原子结构示意图等信息如图所示,回答下列有关问题:
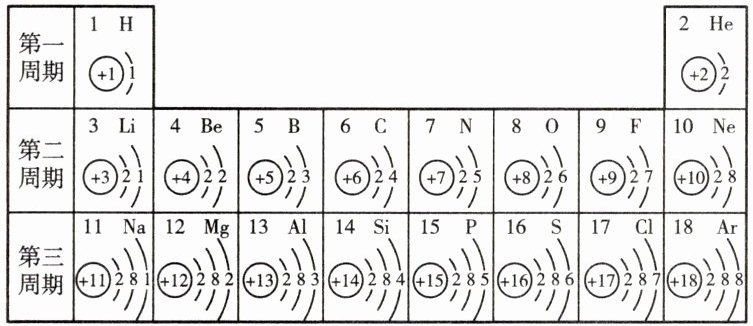
(1)对铟、铱、锌等元素的相对原子质量的测定作出卓越贡献的中国科学家是______。
(2)决定元素种类的是______(填序号)。
①质子数 ②中子数
③核外电子数 ④最外层电子数
(3)在第三周期中,各原子结构的共同之处是______;该周期中,各原子核外电子排布的变化规律是______。
(4)写出一种与氖原子核外电子排布相同的阳离子:______;写出一种与氩原子核外电子排布相同的阴离子:______。
(5)1 个 $ SO_2 $ 中含有______个质子,1 个 $ SO_4^{2-} $ 中含有______个电子。
(6)请结合结构与性质的关系,分析 He 和 Mg 元素的原子最外层电子数相同,化学性质却不同的原因:______。

(1)对铟、铱、锌等元素的相对原子质量的测定作出卓越贡献的中国科学家是______。
(2)决定元素种类的是______(填序号)。
①质子数 ②中子数
③核外电子数 ④最外层电子数
(3)在第三周期中,各原子结构的共同之处是______;该周期中,各原子核外电子排布的变化规律是______。
(4)写出一种与氖原子核外电子排布相同的阳离子:______;写出一种与氩原子核外电子排布相同的阴离子:______。
(5)1 个 $ SO_2 $ 中含有______个质子,1 个 $ SO_4^{2-} $ 中含有______个电子。
(6)请结合结构与性质的关系,分析 He 和 Mg 元素的原子最外层电子数相同,化学性质却不同的原因:______。
答案:
(1)张青莲
(2)①
(3)电子层数相同;从左到右,原子的最外层电子数依次增加
(4)$Na^{+}$(合理即可);$Cl^{-}$(合理即可)
(5)32;50
(6)He原子只有一个电子层,且电子数为2,属于稳定结构;Mg原子有3个电子层,最外层有2个电子,在化学反应中易失去电子,化学性质活泼
点拨:
(2)元素是具有相同质子数(即核电荷数)的一类原子的总称,因此决定元素种类的是质子数。
(4)氖原子核电荷数为10,核外电子排布为2、8,阳离子为原子失电子形成的,故可以从Ne的下一周期找,核外电子排布为2、8的有$Na^{+}$、$Mg^{2+}$、$Al^{3+}$;氩原子核电荷数为18,核外电子排布为2、8、8,阴离子为原子得电子形成的,故可从与Ar同周期,位于Ar前面的元素中找,核外电子排布为2、8、8的有$P^{3-}$、$S^{2-}$、$Cl^{-}$。
(5)1个$SO_{2}$中含有的质子数为$16+2×8=32$,1个$SO_{4}^{2-}$中含有的电子数为$16+4×8+2=50$。
(1)张青莲
(2)①
(3)电子层数相同;从左到右,原子的最外层电子数依次增加
(4)$Na^{+}$(合理即可);$Cl^{-}$(合理即可)
(5)32;50
(6)He原子只有一个电子层,且电子数为2,属于稳定结构;Mg原子有3个电子层,最外层有2个电子,在化学反应中易失去电子,化学性质活泼
点拨:
(2)元素是具有相同质子数(即核电荷数)的一类原子的总称,因此决定元素种类的是质子数。
(4)氖原子核电荷数为10,核外电子排布为2、8,阳离子为原子失电子形成的,故可以从Ne的下一周期找,核外电子排布为2、8的有$Na^{+}$、$Mg^{2+}$、$Al^{3+}$;氩原子核电荷数为18,核外电子排布为2、8、8,阴离子为原子得电子形成的,故可从与Ar同周期,位于Ar前面的元素中找,核外电子排布为2、8、8的有$P^{3-}$、$S^{2-}$、$Cl^{-}$。
(5)1个$SO_{2}$中含有的质子数为$16+2×8=32$,1个$SO_{4}^{2-}$中含有的电子数为$16+4×8+2=50$。
查看更多完整答案,请扫码查看


