第72页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
7. 在化学反应$A+2B= C+2D$中,已知C和D的相对分子质量之比是$22:9$,当6.4gB与足量A完全反应后,生成3.6gD。则在此反应中,B和C的质量比是()
A. $8:11$
B. $2:11$
C. $16:11$
D. $16:9$
A. $8:11$
B. $2:11$
C. $16:11$
D. $16:9$
答案:
C 点拨:已知相对分子质量代入化学方程式进行计算时,要乘以相应的化学计量数。因为C和D的相对分子质量之比是22:9,所以参加反应的C和D的质量比为22:18。设C、D的相对分子质量分别为22a、9a,生成3.6g D时,生成C的质量为x。
$A+2B=C+2D$
22a 18a
x 3.6g
$\frac{22a}{18a}=\frac{x}{3.6g}$
x=4.4g
参加反应的B、C的质量比为6.4g:4.4g=16:11。
$A+2B=C+2D$
22a 18a
x 3.6g
$\frac{22a}{18a}=\frac{x}{3.6g}$
x=4.4g
参加反应的B、C的质量比为6.4g:4.4g=16:11。
8. 2024武汉 化学项目小组用图1所示装置验证质量守恒定律。点燃红磷前电子天平示数为106.23g(见图1)。验证质量守恒定律后,待白烟完全沉降取下橡胶塞,片刻后再一起称量,电子天平示数稳定为106.28g(见图2)。

回答下列问题:
(1)仪器甲的名称为______(填“锥形瓶”或“烧杯”)。
(2)计算参加反应红磷的质量(结果精确到0.01g)。

回答下列问题:
(1)仪器甲的名称为______(填“锥形瓶”或“烧杯”)。
(2)计算参加反应红磷的质量(结果精确到0.01g)。
答案:
解:
(1)锥形瓶
(2)该实验中红磷燃烧消耗氧气,待完全反应后,冷却至室温,由于消耗了氧气,装置内压强减小,打开橡胶塞,空气进入装置中,进入装置内空气的质量约等于消耗氧气的质量,则参加反应的氧气质量为106.28g-106.23g=0.05g。
设参加反应的红磷的质量为x。
$4P+5O_{2}\xlongequal{点燃}2P_{2}O_{5}$
124 160
x 0.05g
$\frac{124}{160}=\frac{x}{0.05g}$
x≈0.04g
答:参加反应的红磷的质量为0.04g。
(1)锥形瓶
(2)该实验中红磷燃烧消耗氧气,待完全反应后,冷却至室温,由于消耗了氧气,装置内压强减小,打开橡胶塞,空气进入装置中,进入装置内空气的质量约等于消耗氧气的质量,则参加反应的氧气质量为106.28g-106.23g=0.05g。
设参加反应的红磷的质量为x。
$4P+5O_{2}\xlongequal{点燃}2P_{2}O_{5}$
124 160
x 0.05g
$\frac{124}{160}=\frac{x}{0.05g}$
x≈0.04g
答:参加反应的红磷的质量为0.04g。
9. 立德树人·科技自信 “蛟龙号”是我国研制出的大深度载人潜水器。为保证载人潜水器长时间潜水,需要在潜水器里配备供氧装置,利用过氧化物供氧是一种常见的供氧技术。
(1)过氧化钠($Na_{2}O_{2}$)作供氧剂的化学方程式为$2Na_{2}O_{2}+2X= 2Na_{2}CO_{3}+O_{2}$,则反应物X的化学式为______。
(2)若用上述方法制取16g氧气,至少需要$Na_{2}O_{2}$的质量为多少?(写出计算过程)
(1)过氧化钠($Na_{2}O_{2}$)作供氧剂的化学方程式为$2Na_{2}O_{2}+2X= 2Na_{2}CO_{3}+O_{2}$,则反应物X的化学式为______。
(2)若用上述方法制取16g氧气,至少需要$Na_{2}O_{2}$的质量为多少?(写出计算过程)
答案:
解:
(1)CO₂
(2)设至少需要Na₂O₂的质量为x。
$2Na_{2}O_{2}+2CO_{2}=2Na_{2}CO_{3}+O_{2}$
156 32
x 16g
$\frac{156}{32}=\frac{x}{16g}$
x=78g
答:至少需要Na₂O₂的质量为78g。
(1)CO₂
(2)设至少需要Na₂O₂的质量为x。
$2Na_{2}O_{2}+2CO_{2}=2Na_{2}CO_{3}+O_{2}$
156 32
x 16g
$\frac{156}{32}=\frac{x}{16g}$
x=78g
答:至少需要Na₂O₂的质量为78g。
10. 实验室用68g过氧化氢溶液和2g二氧化锰制取氧气,实验中非气态物质的总质量随时间变化如图所示。回答下列问题:
(1)反应中生成的氧气的质量为______。
(2)计算该过氧化氢溶液中过氧化氢的质量(写
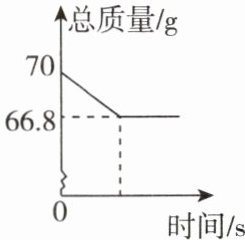
出计算过程)。
(1)反应中生成的氧气的质量为______。
(2)计算该过氧化氢溶液中过氧化氢的质量(写

出计算过程)。
答案:
解:
(1)3.2g
(2)设该过氧化氢溶液中过氧化氢的质量为x。
$2H_{2}O_{2}\xlongequal{MnO_{2}}2H_{2}O+O_{2}\uparrow$
68 32
x 3.2g
$\frac{68}{32}=\frac{x}{3.2g}$
x=6.8g
答:该过氧化氢溶液中过氧化氢的质量为6.8g。
(1)3.2g
(2)设该过氧化氢溶液中过氧化氢的质量为x。
$2H_{2}O_{2}\xlongequal{MnO_{2}}2H_{2}O+O_{2}\uparrow$
68 32
x 3.2g
$\frac{68}{32}=\frac{x}{3.2g}$
x=6.8g
答:该过氧化氢溶液中过氧化氢的质量为6.8g。
11. 为求证“喝反复烧开的饮用水会造成亚硝酸盐中毒”的真伪,学习小组以煮沸52次的桶装水为水样,利用下述反应测定亚硝酸盐的含量(以$NaNO_{2}$计):$2NaNO_{2}+2KI+2H_{2}SO_{4}= 2NO\uparrow +I_{2}+2H_{2}O+K_{2}SO_{4}+Na_{2}SO_{4}$,结果表明,1L水样反应时产生了$5.08×10^{-3}mg的I_{2}$。
(1)计算1L水样中$NaNO_{2}$的质量。
(2)查阅《食品安全国家标准(GB2762-2022)》,经换算,合格饮用水中$NaNO_{2}的含量应低于7.50×10^{-3}mg\cdot L^{-1}$。结合计算结果,得出结论:喝反复烧开的饮用水______(填“会”或“不会”)造成亚硝酸盐中毒。
(1)计算1L水样中$NaNO_{2}$的质量。
(2)查阅《食品安全国家标准(GB2762-2022)》,经换算,合格饮用水中$NaNO_{2}的含量应低于7.50×10^{-3}mg\cdot L^{-1}$。结合计算结果,得出结论:喝反复烧开的饮用水______(填“会”或“不会”)造成亚硝酸盐中毒。
答案:
(1)解:设1L水样中NaNO₂的质量为x。
$2NaNO_{2}+2KI+2H_{2}SO_{4}=I_{2}+2NO\uparrow+2H_{2}O+K_{2}SO_{4}+Na_{2}SO_{4}$
138 254
x 5.08×10⁻³mg
$\frac{138}{254}=\frac{x}{5.08×10^{-3}mg}$
x=2.76×10⁻³mg
答:1L水样中NaNO₂的质量为2.76×10⁻³mg。
(2)不会
(1)解:设1L水样中NaNO₂的质量为x。
$2NaNO_{2}+2KI+2H_{2}SO_{4}=I_{2}+2NO\uparrow+2H_{2}O+K_{2}SO_{4}+Na_{2}SO_{4}$
138 254
x 5.08×10⁻³mg
$\frac{138}{254}=\frac{x}{5.08×10^{-3}mg}$
x=2.76×10⁻³mg
答:1L水样中NaNO₂的质量为2.76×10⁻³mg。
(2)不会
查看更多完整答案,请扫码查看


