第75页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
1. 2025天津河东区期末 实验室用高锰酸钾制取氧气,某次实验中固体的质量变化如下:

请计算:
(1)写出该反应的化学方程式:______。
(2)生成氧气的质量为______。
(3)反应后剩余固体混合物中二氧化锰的质量。

请计算:
(1)写出该反应的化学方程式:______。
(2)生成氧气的质量为______。
(3)反应后剩余固体混合物中二氧化锰的质量。
答案:
解:
(1)$2KMnO_{4}\xlongequal {△}K_{2}MnO_{4}+MnO_{2}+O_{2}\uparrow $
(2)1.6g
(3)设生成二氧化锰的质量为x。
$2KMnO_{4}\xlongequal {△}K_{2}MnO_{4}+MnO_{2}+O_{2}\uparrow $
87 32
x 1.6g
$\frac {87}{32}=\frac {x}{1.6g}$
$x=4.35g$
答:反应后剩余固体混合物中二氧化锰的质量为4.35g。
(1)$2KMnO_{4}\xlongequal {△}K_{2}MnO_{4}+MnO_{2}+O_{2}\uparrow $
(2)1.6g
(3)设生成二氧化锰的质量为x。
$2KMnO_{4}\xlongequal {△}K_{2}MnO_{4}+MnO_{2}+O_{2}\uparrow $
87 32
x 1.6g
$\frac {87}{32}=\frac {x}{1.6g}$
$x=4.35g$
答:反应后剩余固体混合物中二氧化锰的质量为4.35g。
2. 某化学氧自救器的示意图如图所示,化学氧自救器主体是由“生氧罐”供氧,内部装有颗粒状超氧化钾作为“制氧剂”,其中涉及的一个反应为$4KO_{2}+2X= 2K_{2}CO_{3}+3O_{2}$。请回答:
(1)上述反应中X的化学式为______。
(2)根据上述反应,若生成0.96 kg氧气,计算理论上需要消耗超氧化钾的质量。(写出计算过程)
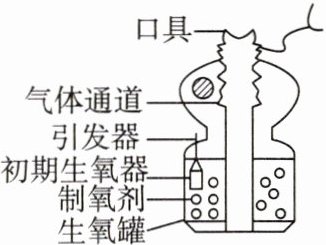
(1)上述反应中X的化学式为______。
(2)根据上述反应,若生成0.96 kg氧气,计算理论上需要消耗超氧化钾的质量。(写出计算过程)

答案:
解:
(1)$CO_{2}$
(2)设理论上需要消耗超氧化钾的质量为x。
$4KO_{2}+2CO_{2}=2K_{2}CO_{3}+3O_{2}$
284 96
x 0.96kg
$\frac {284}{96}=\frac {x}{0.96kg}$
$x=2.84kg$
答:理论上需要消耗超氧化钾的质量为2.84kg。
(1)$CO_{2}$
(2)设理论上需要消耗超氧化钾的质量为x。
$4KO_{2}+2CO_{2}=2K_{2}CO_{3}+3O_{2}$
284 96
x 0.96kg
$\frac {284}{96}=\frac {x}{0.96kg}$
$x=2.84kg$
答:理论上需要消耗超氧化钾的质量为2.84kg。
3. 某兴趣小组为了测定鸡蛋壳中$CaCO_{3}$的质量分数,同学们进行如下实验,将鸡蛋壳洗净、捣碎后准确称量15.0 g,全部投入足量稀盐酸中,电子秤的示数变化情况如图所示:(说明:反应的化学方程式为$CaCO_{3}+2HCl= CaCl_{2}+H_{2}O+CO_{2}\uparrow$,①忽略二氧化碳溶于水对实验结果的影响;②假设其他物质不溶于水,也不与稀盐酸反应)
(1)捣碎鸡蛋壳的目的是______。
(2)根据图示判断:鸡蛋壳中的$CaCO_{3}$与稀盐酸反应生成二氧化碳的质量是______g,根据此数据计算鸡蛋壳中$CaCO_{3}$的质量分数为多少?(写出计算过程,结果精确到0.1%)
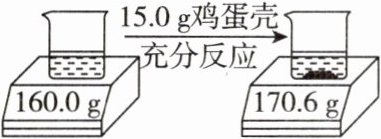
(1)捣碎鸡蛋壳的目的是______。
(2)根据图示判断:鸡蛋壳中的$CaCO_{3}$与稀盐酸反应生成二氧化碳的质量是______g,根据此数据计算鸡蛋壳中$CaCO_{3}$的质量分数为多少?(写出计算过程,结果精确到0.1%)

答案:
(1)增大反应物之间的接触面积,加快反应的速率,使反应物充分反应
(2)4.4;
解:设15.0g鸡蛋壳中参加反应的$CaCO_{3}$的质量为x。
$CaCO_{3}+2HCl=CaCl_{2}+H_{2}O+CO_{2}\uparrow $
100 44
x 4.4g
$\frac {100}{44}=\frac {x}{4.4g}$
$x=10.0g$
鸡蛋壳中$CaCO_{3}$的质量分数为$\frac {10.0g}{15.0g}×100\% \approx 66.7\% $
答:鸡蛋壳中$CaCO_{3}$的质量分数为66.7%。
(1)增大反应物之间的接触面积,加快反应的速率,使反应物充分反应
(2)4.4;
解:设15.0g鸡蛋壳中参加反应的$CaCO_{3}$的质量为x。
$CaCO_{3}+2HCl=CaCl_{2}+H_{2}O+CO_{2}\uparrow $
100 44
x 4.4g
$\frac {100}{44}=\frac {x}{4.4g}$
$x=10.0g$
鸡蛋壳中$CaCO_{3}$的质量分数为$\frac {10.0g}{15.0g}×100\% \approx 66.7\% $
答:鸡蛋壳中$CaCO_{3}$的质量分数为66.7%。
查看更多完整答案,请扫码查看


