2025年高考必刷题高三化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年高考必刷题高三化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第97页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
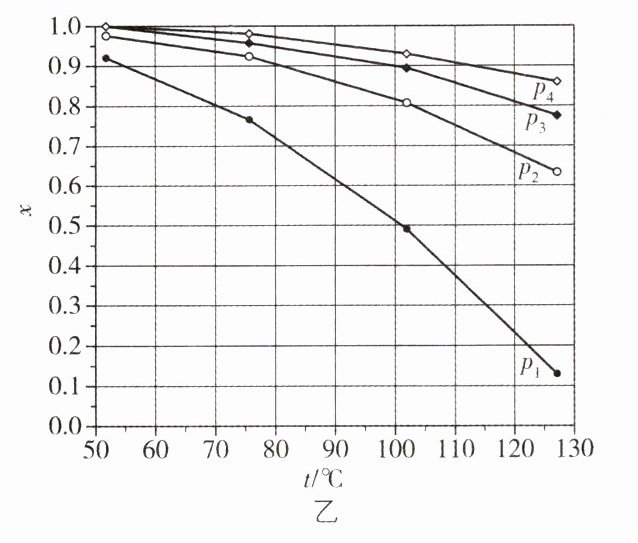
1. [新课标 2024·29节选](1)在总压分别为0.10、0.50、1.0、2.0 MPa下,Ni(s)和CO(g)反应达平衡时,$Ni(CO)_{4}$体积分数$x$与温度的关系如图乙所示。反应$Ni(s)+4CO(g)\xlongequal{\;\;}Ni(CO)_{4}(g)$的$\Delta H$______0(填“大于”或“小于”)。从热力学角度考虑,______有利于$Ni(CO)_{4}$的生成(写出两点)。$p_{3}$、100℃时CO的平衡转化率$\alpha =$__________,该温度下平衡常数$K_{p}=$__________$(MPa)^{-3}$。
(2)对于同位素交换反应$Ni(C^{16}O)_{4}+C^{18}O\rightarrow Ni(C^{16}O)_{3}C^{18}O + C^{16}O$,20℃时反应物浓度随时间的变化关系为$c_{t}[Ni(C^{16}O)_{4}]=c_{0}[Ni(C^{16}O)_{4}]e^{-kt}$($k$为反应速率常数),则$Ni(C^{16}O)_{4}$反应一半所需时间$t_{\frac{1}{2}}=$________(用$k$表示)。

(2)对于同位素交换反应$Ni(C^{16}O)_{4}+C^{18}O\rightarrow Ni(C^{16}O)_{3}C^{18}O + C^{16}O$,20℃时反应物浓度随时间的变化关系为$c_{t}[Ni(C^{16}O)_{4}]=c_{0}[Ni(C^{16}O)_{4}]e^{-kt}$($k$为反应速率常数),则$Ni(C^{16}O)_{4}$反应一半所需时间$t_{\frac{1}{2}}=$________(用$k$表示)。
答案:
(1) 小于 降低温度、增大压强 97.3% 9 000
(2)$\frac{\ln 2}{k}$ **命题点**:化学反应原理综合,涉及电子排布、晶胞相关计算、σ键、晶体类型、化学平衡移动、转化率与平衡常数计算、反应速率模型的分析等 【解析】
(1) 随着温度升高,平衡时Ni(CO)₄的体积分数减小,说明温度升高平衡逆移,因此该反应的$\Delta H<0$。该反应的正反应是气体总分子数减小的放热反应,因此降低温度和增大压强均有利于Ni(CO)₄的生成。由上述分析知,温度相同时,增大压强平衡正向移动,对应的平衡体系中Ni(CO)₄的体积分数增大,则压强:p₄>p₃>p₂>p₁,即p₃对应的压强是1.0 MPa。由题图乙可知,p₃、100℃条件下达到平衡时,CO和Ni(CO)₄的物质的量分数分别为0.1、0.9,设初始投入的CO为4 mol,反应生成的Ni(CO)₄为x mol,可得三段式: $ \begin{array}{cccc} &Ni(s)+4CO(g)&\rightleftharpoons&Ni(CO)_4(g)&n_{气总}\\ n_{起始}/mol&4&0&4\\ n_{转化}/mol&4x&x\\ n_{平衡}/mol&4 - 4x&x&4 - 3x \end{array} $ 根据阿伏加德罗定律,其他条件相同时,气体的体积分数即为其物质的量分数,因此有$\frac{x}{4 - 3x}=0.9$,解得$x = \frac{36}{37}$,因此达到平衡时$n_{转化}(CO)=4×\frac{36}{37}mol$,CO的平衡转化率$\alpha=\frac{4×\frac{36}{37}mol}{4mol}×100\%\approx97.3\%$。气体的分压 = 总压强×该气体的物质的量分数,则该温度下的压强平衡常数$K_p=\frac{p[Ni(CO)_4]}{p^4(CO)}=\frac{0.9×p_3}{(0.1×p_3)^4}=\frac{0.9×1.0 MPa}{(0.1×1.0 MPa)^4}=9 000(MPa)^{-3}$。
(2) 由题给关系式可得$e^{-kt}=\frac{c_t[Ni(C^{16}O)_4]}{c_0[Ni(C^{16}O)_4]}$,当$Ni(C^{16}O)_4$反应一半时,$\frac{c_t[Ni(C^{16}O)_4]}{c_0[Ni(C^{16}O)_4]}=\frac{1}{2}$,即$e^{-kt_{\frac{1}{2}}}=\frac{1}{2}$,$-kt_{\frac{1}{2}}=\ln\frac{1}{2}$,$kt_{\frac{1}{2}}=\ln 2$,则$t_{\frac{1}{2}}=\frac{\ln 2}{k}$。
(1) 小于 降低温度、增大压强 97.3% 9 000
(2)$\frac{\ln 2}{k}$ **命题点**:化学反应原理综合,涉及电子排布、晶胞相关计算、σ键、晶体类型、化学平衡移动、转化率与平衡常数计算、反应速率模型的分析等 【解析】
(1) 随着温度升高,平衡时Ni(CO)₄的体积分数减小,说明温度升高平衡逆移,因此该反应的$\Delta H<0$。该反应的正反应是气体总分子数减小的放热反应,因此降低温度和增大压强均有利于Ni(CO)₄的生成。由上述分析知,温度相同时,增大压强平衡正向移动,对应的平衡体系中Ni(CO)₄的体积分数增大,则压强:p₄>p₃>p₂>p₁,即p₃对应的压强是1.0 MPa。由题图乙可知,p₃、100℃条件下达到平衡时,CO和Ni(CO)₄的物质的量分数分别为0.1、0.9,设初始投入的CO为4 mol,反应生成的Ni(CO)₄为x mol,可得三段式: $ \begin{array}{cccc} &Ni(s)+4CO(g)&\rightleftharpoons&Ni(CO)_4(g)&n_{气总}\\ n_{起始}/mol&4&0&4\\ n_{转化}/mol&4x&x\\ n_{平衡}/mol&4 - 4x&x&4 - 3x \end{array} $ 根据阿伏加德罗定律,其他条件相同时,气体的体积分数即为其物质的量分数,因此有$\frac{x}{4 - 3x}=0.9$,解得$x = \frac{36}{37}$,因此达到平衡时$n_{转化}(CO)=4×\frac{36}{37}mol$,CO的平衡转化率$\alpha=\frac{4×\frac{36}{37}mol}{4mol}×100\%\approx97.3\%$。气体的分压 = 总压强×该气体的物质的量分数,则该温度下的压强平衡常数$K_p=\frac{p[Ni(CO)_4]}{p^4(CO)}=\frac{0.9×p_3}{(0.1×p_3)^4}=\frac{0.9×1.0 MPa}{(0.1×1.0 MPa)^4}=9 000(MPa)^{-3}$。
(2) 由题给关系式可得$e^{-kt}=\frac{c_t[Ni(C^{16}O)_4]}{c_0[Ni(C^{16}O)_4]}$,当$Ni(C^{16}O)_4$反应一半时,$\frac{c_t[Ni(C^{16}O)_4]}{c_0[Ni(C^{16}O)_4]}=\frac{1}{2}$,即$e^{-kt_{\frac{1}{2}}}=\frac{1}{2}$,$-kt_{\frac{1}{2}}=\ln\frac{1}{2}$,$kt_{\frac{1}{2}}=\ln 2$,则$t_{\frac{1}{2}}=\frac{\ln 2}{k}$。
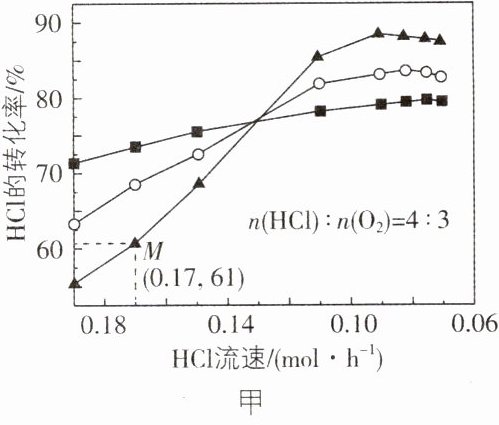
2. [黑吉辽 2024·18,13分]为实现氯资源循环利用,工业上采用$RuO_{2}$催化氧化法处理HCl废气:
$2HCl(g)+\frac{1}{2}O_{2}(g)\rightleftharpoons Cl_{2}(g)+H_{2}O(g)$ $\Delta H_{1}=-57.2kJ\cdot mol^{-1}$ $\Delta S$ $K$
将HCl和$O_{2}$分别以不同起始流速通入反应器中,在360℃、400℃和440℃下反应,通过检测流出气成分绘制HCl转化率($\alpha$)曲线,如图所示(较低流速下转化率可近似为平衡转化率)。

回答下列问题:
(1)$\Delta S$______0(填“>”或“<”);$T_{3}=$________℃。
(2)结合以下信息,可知$H_{2}$的燃烧热$\Delta H=$________$kJ\cdot mol^{-1}$。
$H_{2}O(l)\xlongequal{\;\;}H_{2}O(g)$ $\Delta H_{2}=+44.0kJ\cdot mol^{-1}$
$H_{2}(g)+Cl_{2}(g)\xlongequal{\;\;}2HCl(g)$ $\Delta H_{3}=-184.6kJ\cdot mol^{-1}$
(3)下列措施可提高M点HCl转化率的是______(填序号)。
A. 增大HCl的流速
B. 将温度升高40℃
C. 增大$n(HCl):n(O_{2})$
D. 使用更高效的催化剂
(4)图中较高流速时,$\alpha(T_{3})$小于$\alpha(T_{2})$和$\alpha(T_{1})$,原因是______________________________。
(5)设N点的转化率为平衡转化率,则该温度下反应的平衡常数$K=$________(用平衡物质的量分数代替平衡浓度计算)。
$2HCl(g)+\frac{1}{2}O_{2}(g)\rightleftharpoons Cl_{2}(g)+H_{2}O(g)$ $\Delta H_{1}=-57.2kJ\cdot mol^{-1}$ $\Delta S$ $K$
将HCl和$O_{2}$分别以不同起始流速通入反应器中,在360℃、400℃和440℃下反应,通过检测流出气成分绘制HCl转化率($\alpha$)曲线,如图所示(较低流速下转化率可近似为平衡转化率)。


回答下列问题:
(1)$\Delta S$______0(填“>”或“<”);$T_{3}=$________℃。
(2)结合以下信息,可知$H_{2}$的燃烧热$\Delta H=$________$kJ\cdot mol^{-1}$。
$H_{2}O(l)\xlongequal{\;\;}H_{2}O(g)$ $\Delta H_{2}=+44.0kJ\cdot mol^{-1}$
$H_{2}(g)+Cl_{2}(g)\xlongequal{\;\;}2HCl(g)$ $\Delta H_{3}=-184.6kJ\cdot mol^{-1}$
(3)下列措施可提高M点HCl转化率的是______(填序号)。
A. 增大HCl的流速
B. 将温度升高40℃
C. 增大$n(HCl):n(O_{2})$
D. 使用更高效的催化剂
(4)图中较高流速时,$\alpha(T_{3})$小于$\alpha(T_{2})$和$\alpha(T_{1})$,原因是______________________________。
(5)设N点的转化率为平衡转化率,则该温度下反应的平衡常数$K=$________(用平衡物质的量分数代替平衡浓度计算)。
答案:
(1) < 360
(2) - 285.8
(3) BD
(4) 流速较高时,未达到平衡,T₃、T₂、T₁对应的反应温度分别为360℃、400℃、440℃,随着温度升高,反应速率加快,HCl转化率增大
(5) 6 **命题点**:熵变、化学平衡移动、盖斯定律、化学反应速率的影响因素、化学平衡常数的计算等 【解析】
(1) 该反应为气体分子总数减少的反应,即熵减的反应,则$\Delta S<0$;该反应为放热反应,温度升高,平衡逆向移动,HCl平衡转化率降低,根据信息“较低流速下转化率可近似为平衡转化率”,结合图像可知,低流速时,T₃、T₂、T₁对应的HCl转化率依次降低,则T₃、T₂、T₁对应的反应温度依次升高,分别为360℃、400℃、440℃。
(2) $H_2$燃烧的热化学方程式为$H_2(g)+\frac{1}{2}O_2 = H_2O(l)$ $\Delta H$,根据盖斯定律,$\Delta H=\Delta H_1+\Delta H_3-\Delta H_2=(-57.2 kJ·mol^{-1})+(-184.6 kJ·mol^{-1})-(+44 kJ·mol^{-1})=-285.8 kJ·mol^{-1}$。
(3) 根据图甲可知,T₃温度对应的曲线中,随着HCl流速的增大,HCl的转化率下降,A错误;M点对应的HCl流速较高,未达到平衡状态,升高温度,可加快反应速率,提高HCl的转化率,结合图甲可知,HCl流速相同时,将温度升高40℃,即温度为400℃,此时HCl的转化率增大,B正确;由图甲、乙可知,温度、HCl流速相同时,增大n(HCl):n(O₂),HCl转化率下降,C错误;使用更高效的催化剂,可加快反应速率,从而提高M点HCl的转化率,D正确。
(4) 流速较高时,反应未达到平衡,则影响转化率的主要因素是反应速率,而本题影响速率的因素是温度,故从温度的角度来分析。
(5) 代入1 h内的气体流量,图乙中n(HCl):n(O₂)=4:4,则N点通入的HCl、O₂物质的量均为0.10 mol,根据图乙数据可知,平衡时HCl转化率为80%,即HCl转化的物质的量为0.08 mol,可列出三段式: $ \begin{array}{cccccc} &2HCl(g)&+\frac{1}{2}O_2(g)&\rightleftharpoons&Cl_2(g)&+H_2O(g)\\ n_{起始}/mol&0.10&0.10&0&0\\ n_{转化}/mol&0.08&0.02&0.04&0.04\\ n_{平衡}/mol&0.02&0.08&0.04&0.04 \end{array} $ 平衡时气体总物质的量$n_{总}=(0.02 + 0.08 + 0.04 + 0.04)mol = 0.18 mol$,则物质的量分数$x(HCl)=\frac{1}{9}$,$x(O_2)=\frac{4}{9}$,$x(Cl_2)=\frac{2}{9}$,$x(H_2O)=\frac{2}{9}$,将数据代入平衡常数表达式得$K=\frac{\frac{2}{9}×\frac{2}{9}}{(\frac{1}{9})^2×(\frac{4}{9})^{\frac{1}{2}}}=6$。
(1) < 360
(2) - 285.8
(3) BD
(4) 流速较高时,未达到平衡,T₃、T₂、T₁对应的反应温度分别为360℃、400℃、440℃,随着温度升高,反应速率加快,HCl转化率增大
(5) 6 **命题点**:熵变、化学平衡移动、盖斯定律、化学反应速率的影响因素、化学平衡常数的计算等 【解析】
(1) 该反应为气体分子总数减少的反应,即熵减的反应,则$\Delta S<0$;该反应为放热反应,温度升高,平衡逆向移动,HCl平衡转化率降低,根据信息“较低流速下转化率可近似为平衡转化率”,结合图像可知,低流速时,T₃、T₂、T₁对应的HCl转化率依次降低,则T₃、T₂、T₁对应的反应温度依次升高,分别为360℃、400℃、440℃。
(2) $H_2$燃烧的热化学方程式为$H_2(g)+\frac{1}{2}O_2 = H_2O(l)$ $\Delta H$,根据盖斯定律,$\Delta H=\Delta H_1+\Delta H_3-\Delta H_2=(-57.2 kJ·mol^{-1})+(-184.6 kJ·mol^{-1})-(+44 kJ·mol^{-1})=-285.8 kJ·mol^{-1}$。
(3) 根据图甲可知,T₃温度对应的曲线中,随着HCl流速的增大,HCl的转化率下降,A错误;M点对应的HCl流速较高,未达到平衡状态,升高温度,可加快反应速率,提高HCl的转化率,结合图甲可知,HCl流速相同时,将温度升高40℃,即温度为400℃,此时HCl的转化率增大,B正确;由图甲、乙可知,温度、HCl流速相同时,增大n(HCl):n(O₂),HCl转化率下降,C错误;使用更高效的催化剂,可加快反应速率,从而提高M点HCl的转化率,D正确。
(4) 流速较高时,反应未达到平衡,则影响转化率的主要因素是反应速率,而本题影响速率的因素是温度,故从温度的角度来分析。
(5) 代入1 h内的气体流量,图乙中n(HCl):n(O₂)=4:4,则N点通入的HCl、O₂物质的量均为0.10 mol,根据图乙数据可知,平衡时HCl转化率为80%,即HCl转化的物质的量为0.08 mol,可列出三段式: $ \begin{array}{cccccc} &2HCl(g)&+\frac{1}{2}O_2(g)&\rightleftharpoons&Cl_2(g)&+H_2O(g)\\ n_{起始}/mol&0.10&0.10&0&0\\ n_{转化}/mol&0.08&0.02&0.04&0.04\\ n_{平衡}/mol&0.02&0.08&0.04&0.04 \end{array} $ 平衡时气体总物质的量$n_{总}=(0.02 + 0.08 + 0.04 + 0.04)mol = 0.18 mol$,则物质的量分数$x(HCl)=\frac{1}{9}$,$x(O_2)=\frac{4}{9}$,$x(Cl_2)=\frac{2}{9}$,$x(H_2O)=\frac{2}{9}$,将数据代入平衡常数表达式得$K=\frac{\frac{2}{9}×\frac{2}{9}}{(\frac{1}{9})^2×(\frac{4}{9})^{\frac{1}{2}}}=6$。
3. [安徽 2024·17,15分]乙烯是一种用途广泛的有机化工原料。由乙烷制乙烯的研究备受关注。回答下列问题:
【乙烷制乙烯】
(1)$C_{2}H_{6}$氧化脱氢反应:
$2C_{2}H_{6}(g)+O_{2}(g)\xlongequal{\;\;}2C_{2}H_{4}(g)+2H_{2}O(g)$ $\Delta H_{1}=-209.8kJ\cdot mol^{-1}$
$C_{2}H_{6}(g)+CO_{2}(g)\xlongequal{\;\;}C_{2}H_{4}(g)+H_{2}O(g)+CO(g)$ $\Delta H_{2}=178.1kJ\cdot mol^{-1}$
计算:$2CO(g)+O_{2}(g)\xlongequal{\;\;}2CO_{2}(g)$ $\Delta H_{3}=$________$kJ\cdot mol^{-1}$。
(2)$C_{2}H_{6}$直接脱氢反应为$C_{2}H_{6}(g)\xlongequal{\;\;}C_{2}H_{4}(g)+H_{2}(g)$ $\Delta H_{4}$、$C_{2}H_{6}$的平衡转化率与温度和压强的关系如图甲所示,则$\Delta H_{4}$______0(填“>”“<”或“=”)。结合图甲,下列条件中,达到平衡时转化率最接近40%的是______(填序号)。

a. 600℃、0.6 MPa
b. 700℃、0.7 MPa
c. 800℃、0.8 MPa
(3)一定温度和压强下,
反应ⅰ $C_{2}H_{6}(g)\rightleftharpoons C_{2}H_{4}(g)+H_{2}(g)$ $K_{x1}$
反应ⅱ $C_{2}H_{6}(g)+H_{2}(g)\rightleftharpoons 2CH_{4}(g)$ $K_{x2}$($K_{x2}$远大于$K_{x1}$)
($K_{x}$是以平衡物质的量分数代替平衡浓度计算的平衡常数)
①仅发生反应ⅰ时,$C_{2}H_{6}$的平衡转化率为25.0%,计算$K_{x1}=$________。
②同时发生反应ⅰ和ⅱ时,与仅发生反应ⅰ相比,$C_{2}H_{4}$的平衡产率________(填“增大”“减小”或“不变”)。
【乙烷和乙烯混合气的分离】
(4)通过$Cu^{+}$修饰的Y分子筛的吸附 - 脱附,可实现$C_{2}H_{4}$和$C_{2}H_{6}$混合气的分离。$Cu^{+}$的________与$C_{2}H_{4}$分子的$\pi$键电子形成配位键,这种配位键强弱介于范德华力和共价键之间。用该分子筛分离$C_{2}H_{4}$和$C_{2}H_{6}$的优点是______________________。
(5)常温常压下,将$C_{2}H_{4}$和$C_{2}H_{6}$等体积混合,以一定流速通过某吸附剂,测得两种气体出口浓度($c$)与进口浓度($c_{0}$)之比随时间变化关系如图乙所示。下列推断合理的是________(填序号)。
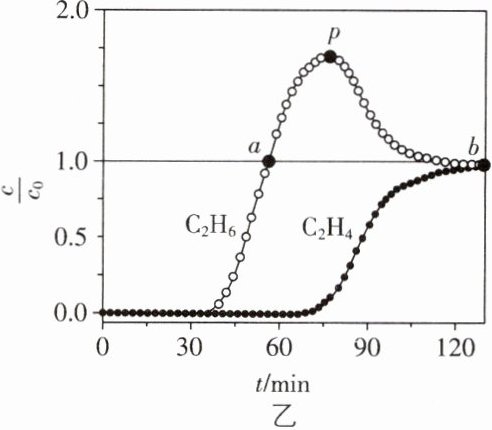
A. 前30 min,两种气体均未被吸附
B. p点对应的时刻,出口气体的主要成分是$C_{2}H_{6}$
C. $a - b$对应的时间段内,吸附的$C_{2}H_{6}$逐渐被$C_{2}H_{4}$替代
【乙烷制乙烯】
(1)$C_{2}H_{6}$氧化脱氢反应:
$2C_{2}H_{6}(g)+O_{2}(g)\xlongequal{\;\;}2C_{2}H_{4}(g)+2H_{2}O(g)$ $\Delta H_{1}=-209.8kJ\cdot mol^{-1}$
$C_{2}H_{6}(g)+CO_{2}(g)\xlongequal{\;\;}C_{2}H_{4}(g)+H_{2}O(g)+CO(g)$ $\Delta H_{2}=178.1kJ\cdot mol^{-1}$
计算:$2CO(g)+O_{2}(g)\xlongequal{\;\;}2CO_{2}(g)$ $\Delta H_{3}=$________$kJ\cdot mol^{-1}$。
(2)$C_{2}H_{6}$直接脱氢反应为$C_{2}H_{6}(g)\xlongequal{\;\;}C_{2}H_{4}(g)+H_{2}(g)$ $\Delta H_{4}$、$C_{2}H_{6}$的平衡转化率与温度和压强的关系如图甲所示,则$\Delta H_{4}$______0(填“>”“<”或“=”)。结合图甲,下列条件中,达到平衡时转化率最接近40%的是______(填序号)。

a. 600℃、0.6 MPa
b. 700℃、0.7 MPa
c. 800℃、0.8 MPa
(3)一定温度和压强下,
反应ⅰ $C_{2}H_{6}(g)\rightleftharpoons C_{2}H_{4}(g)+H_{2}(g)$ $K_{x1}$
反应ⅱ $C_{2}H_{6}(g)+H_{2}(g)\rightleftharpoons 2CH_{4}(g)$ $K_{x2}$($K_{x2}$远大于$K_{x1}$)
($K_{x}$是以平衡物质的量分数代替平衡浓度计算的平衡常数)
①仅发生反应ⅰ时,$C_{2}H_{6}$的平衡转化率为25.0%,计算$K_{x1}=$________。
②同时发生反应ⅰ和ⅱ时,与仅发生反应ⅰ相比,$C_{2}H_{4}$的平衡产率________(填“增大”“减小”或“不变”)。
【乙烷和乙烯混合气的分离】
(4)通过$Cu^{+}$修饰的Y分子筛的吸附 - 脱附,可实现$C_{2}H_{4}$和$C_{2}H_{6}$混合气的分离。$Cu^{+}$的________与$C_{2}H_{4}$分子的$\pi$键电子形成配位键,这种配位键强弱介于范德华力和共价键之间。用该分子筛分离$C_{2}H_{4}$和$C_{2}H_{6}$的优点是______________________。
(5)常温常压下,将$C_{2}H_{4}$和$C_{2}H_{6}$等体积混合,以一定流速通过某吸附剂,测得两种气体出口浓度($c$)与进口浓度($c_{0}$)之比随时间变化关系如图乙所示。下列推断合理的是________(填序号)。

A. 前30 min,两种气体均未被吸附
B. p点对应的时刻,出口气体的主要成分是$C_{2}H_{6}$
C. $a - b$对应的时间段内,吸附的$C_{2}H_{6}$逐渐被$C_{2}H_{4}$替代
答案:
(1) - 566.0
(2) > b
(3) ①$\frac{1}{15}$ ②增大
(4) 4s轨道 分离效果好且不破坏C₂H₄分子的结构
(5) BC **命题点**:化学反应原理综合,涉及盖斯定律、化学平衡、平衡常数的计算、物质结构等 【解析】
(1) 由盖斯定律可得目标反应的反应热$\Delta H_3=\Delta H_1 - 2\Delta H_2=(-209.8 kJ·mol^{-1})-2×178.1 kJ·mol^{-1}=-566.0 kJ·mol^{-1}$。
(2) 由图甲可知其他条件相同时,随着温度的升高,C₂H₆的平衡转化率逐渐增大,即该反应是吸热反应,所以$\Delta H_4>0$。由图甲可知600℃、0.6 MPa时,C₂H₆平衡转化率略小于20%,700℃、0.7 MPa时,C₂H₆平衡转化率略小于50%,800℃、0.8 MPa时,C₂H₆平衡转化率大于50%小于80%,故选b。
(3) ①设起始时充入n mol C₂H₆,由于仅发生反应ⅰ,且C₂H₆的平衡转化率为25.0%,则达到平衡时C₂H₆、C₂H₄、H₂的物质的量分别是0.75n mol、0.25n mol、0.25n mol,平衡时气体总物质的量$n_{总}=1.25n mol$,则平衡时C₂H₆、C₂H₄、H₂的物质的量分数分别是0.6、0.2、0.2,所以$K_{p1}=\frac{0.2×0.2}{0.6}=\frac{1}{15}$。②反应ⅰ生成的H₂促进反应ⅱ正向进行,同时H₂的消耗也促进反应ⅰ正向进行,所以C₂H₄的平衡产率增大。
(4) 基态Cu⁺的价层电子排布式为3d¹⁰,4s轨道为空轨道,因此Cu⁺的4s轨道和C₂H₄分子的π键电子形成配位键。通过该分子筛的吸附和脱附可实现C₂H₄和C₂H₆混合气的分离,由于该配位键强弱介于范德华力和共价键之间,所以可以通过直接吸附C₂H₄分离出C₂H₆,而不破坏C₂H₄的分子结构,且吸附的C₂H₄也容易被释放出来。
(5) 根据图乙可知,前30 min两种气体的出口浓度与进口浓度之比为0,说明两种气体均被吸附,A错误;p点对应时刻,C₂H₆的出口浓度与进口浓度之比达到最大值,而C₂H₄的出口浓度与进口浓度之比接近0.1,所以该时刻出口气体的主要成分是C₂H₆,B正确;a~b对应的时间段内,C₂H₆对应的$\frac{c}{c_0}>1.0$,说明C₂H₆在脱附,C₂H₄对应的$\frac{c}{c_0}<1.0$,说明C₂H₄在被吸附,即吸附的C₂H₆逐渐被C₂H₄替代,C正确。
(1) - 566.0
(2) > b
(3) ①$\frac{1}{15}$ ②增大
(4) 4s轨道 分离效果好且不破坏C₂H₄分子的结构
(5) BC **命题点**:化学反应原理综合,涉及盖斯定律、化学平衡、平衡常数的计算、物质结构等 【解析】
(1) 由盖斯定律可得目标反应的反应热$\Delta H_3=\Delta H_1 - 2\Delta H_2=(-209.8 kJ·mol^{-1})-2×178.1 kJ·mol^{-1}=-566.0 kJ·mol^{-1}$。
(2) 由图甲可知其他条件相同时,随着温度的升高,C₂H₆的平衡转化率逐渐增大,即该反应是吸热反应,所以$\Delta H_4>0$。由图甲可知600℃、0.6 MPa时,C₂H₆平衡转化率略小于20%,700℃、0.7 MPa时,C₂H₆平衡转化率略小于50%,800℃、0.8 MPa时,C₂H₆平衡转化率大于50%小于80%,故选b。
(3) ①设起始时充入n mol C₂H₆,由于仅发生反应ⅰ,且C₂H₆的平衡转化率为25.0%,则达到平衡时C₂H₆、C₂H₄、H₂的物质的量分别是0.75n mol、0.25n mol、0.25n mol,平衡时气体总物质的量$n_{总}=1.25n mol$,则平衡时C₂H₆、C₂H₄、H₂的物质的量分数分别是0.6、0.2、0.2,所以$K_{p1}=\frac{0.2×0.2}{0.6}=\frac{1}{15}$。②反应ⅰ生成的H₂促进反应ⅱ正向进行,同时H₂的消耗也促进反应ⅰ正向进行,所以C₂H₄的平衡产率增大。
(4) 基态Cu⁺的价层电子排布式为3d¹⁰,4s轨道为空轨道,因此Cu⁺的4s轨道和C₂H₄分子的π键电子形成配位键。通过该分子筛的吸附和脱附可实现C₂H₄和C₂H₆混合气的分离,由于该配位键强弱介于范德华力和共价键之间,所以可以通过直接吸附C₂H₄分离出C₂H₆,而不破坏C₂H₄的分子结构,且吸附的C₂H₄也容易被释放出来。
(5) 根据图乙可知,前30 min两种气体的出口浓度与进口浓度之比为0,说明两种气体均被吸附,A错误;p点对应时刻,C₂H₆的出口浓度与进口浓度之比达到最大值,而C₂H₄的出口浓度与进口浓度之比接近0.1,所以该时刻出口气体的主要成分是C₂H₆,B正确;a~b对应的时间段内,C₂H₆对应的$\frac{c}{c_0}>1.0$,说明C₂H₆在脱附,C₂H₄对应的$\frac{c}{c_0}<1.0$,说明C₂H₄在被吸附,即吸附的C₂H₆逐渐被C₂H₄替代,C正确。
查看更多完整答案,请扫码查看


