2025年高考必刷题高三化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年高考必刷题高三化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第75页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
1. [浙江 2024 年 1 月·13,3 分]破损的镀锌铁皮在氨水中发生电化学腐蚀,生成$[Zn(NH_{3})_{4}]^{2+}$和$H_{2}$,下列说法不正确的是( )
A. 氨水浓度越大,腐蚀趋势越大
B. 随着腐蚀的进行,溶液的 pH 变大
C. 铁电极上的电极反应式为$2NH_{3}+2e^{-}\xlongequal{\;\;}2NH_{2}^{-}+H_{2}\uparrow$
D. 每生成标准状况下 224 mL$H_{2}$,消耗 0.010 mol Zn
A. 氨水浓度越大,腐蚀趋势越大
B. 随着腐蚀的进行,溶液的 pH 变大
C. 铁电极上的电极反应式为$2NH_{3}+2e^{-}\xlongequal{\;\;}2NH_{2}^{-}+H_{2}\uparrow$
D. 每生成标准状况下 224 mL$H_{2}$,消耗 0.010 mol Zn
答案:
C 命题点·金属的电化学腐蚀
【解析】镀锌铁皮在氨水中发生电化学腐蚀时,锌为负极,电极反应式为${Zn + 4NH_{3}-2e^{-}=[Zn(NH_{3})_{4}]^{2 + }}$,${NH_{3}}$为负极反应的反应物,因此氨水的浓度越大,负极反应的速率越大,即腐蚀趋势越大,A正确;铁为正极,在碱性溶液中,电极反应式为${2H_{2}O + 2e^{-}=H_{2}\uparrow+ 2OH^{-}}$,因此随着反应的进行,$c({OH^{-}})$增大,即溶液的pH变大,B正确、C错误;根据正极反应式可知,每生成$1\ \text{mol}\ {H_{2}}$,转移$2\ \text{mol}$电子,负极消耗$1\ \text{mol}\ {Zn}$,标准状况下$224\ \text{mL}\ {H_{2}}$的物质的量是$0.010\ \text{mol}$,因此消耗$0.010\ \text{mol}\ {Zn}$,D正确。
2. [新课标 2023·10,6 分]一种以$V_{2}O_{5}$和 Zn 为电极、$Zn(CF_{3}SO_{3})_{2}$水溶液为电解质的电池,其示意图如图所示。放电时,$Zn^{2+}$可插入$V_{2}O_{5}$层间形成$Zn_{x}V_{2}O_{5}\cdot nH_{2}O$。下列说法错误的是( )

A. 放电时$V_{2}O_{5}$为正极
B. 放电时$Zn^{2+}$由负极向正极迁移
C. 充电总反应:$xZn+V_{2}O_{5}+nH_{2}O\xlongequal{\;\;}Zn_{x}V_{2}O_{5}\cdot nH_{2}O$
D. 充电阳极反应:$Zn_{x}V_{2}O_{5}\cdot nH_{2}O - 2xe^{-}\xlongequal{\;\;}xZn^{2+}+V_{2}O_{5}+nH_{2}O$

A. 放电时$V_{2}O_{5}$为正极
B. 放电时$Zn^{2+}$由负极向正极迁移
C. 充电总反应:$xZn+V_{2}O_{5}+nH_{2}O\xlongequal{\;\;}Zn_{x}V_{2}O_{5}\cdot nH_{2}O$
D. 充电阳极反应:$Zn_{x}V_{2}O_{5}\cdot nH_{2}O - 2xe^{-}\xlongequal{\;\;}xZn^{2+}+V_{2}O_{5}+nH_{2}O$
答案:
C 命题点·二次电池的工作原理
**思路导引**
|过程|电极判断|
| ---- | ---- |
|放电|${Zn}$为活泼金属,放电时失电子发生氧化反应→${Zn}$电极为负极,则${V_{2}O_{5}}$电极为正极(A正确)|
|充电|结合上述分析,充电时${Zn}$电极为阴极,则${V_{2}O_{5}}$电极为阳极|
【解析】放电时,阳离子向正极迁移,即${Zn^{2 + }}$由负极向正极迁移,B正确;由题意知,放电时,${Zn^{2 + }}$插入${V_{2}O_{5}}$层间形成${Zn_{x}V_{2}O_{5}\cdot nH_{2}O}$,则充电的总反应为${Zn_{x}V_{2}O_{5}\cdot nH_{2}O\xlongequal{电解}xZn + V_{2}O_{5}+ nH_{2}O}$,C错误;充电时,${V_{2}O_{5}}$电极为阳极,阳极发生氧化反应,结合C选项可知阳极$1\ \text{mol}\ {Zn_{x}V_{2}O_{5}\cdot nH_{2}O}$失去$2x\ \text{mol}\ e^{-}$得到$x\ \text{mol}\ {Zn^{2 + }}$、$1\ \text{mol}\ {V_{2}O_{5}}$和$n\ \text{mol}\ {H_{2}O}$,结合电荷守恒和质量守恒可知题给阳极反应无误,D正确。
3. [黑吉辽 2024·12,3 分]“绿色零碳”氢能前景广阔。为解决传统电解水制“绿氢”阳极电势高、反应速率缓慢的问题,科技工作者设计耦合 HCHO 高效制$H_{2}$的方法,装置如图所示。部分反应机理为 下列说法错误的是( )
下列说法错误的是( )
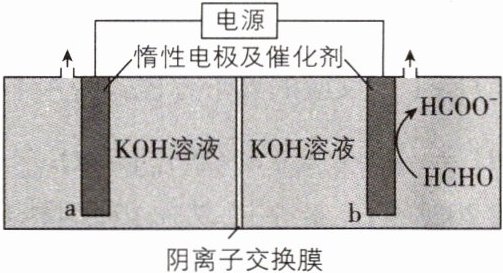
A. 相同电量下$H_{2}$理论产量是传统电解水的 1.5 倍
B. 阴极反应:$2H_{2}O + 2e^{-}\xlongequal{\;\;}2OH^{-}+H_{2}\uparrow$
C. 电解时$OH^{-}$通过阴离子交换膜向 b 极方向移动
D. 阳极反应:$2HCHO - 2e^{-}+4OH^{-}\xlongequal{\;\;}2HCOO^{-}+2H_{2}O + H_{2}\uparrow$
 下列说法错误的是( )
下列说法错误的是( )
A. 相同电量下$H_{2}$理论产量是传统电解水的 1.5 倍
B. 阴极反应:$2H_{2}O + 2e^{-}\xlongequal{\;\;}2OH^{-}+H_{2}\uparrow$
C. 电解时$OH^{-}$通过阴离子交换膜向 b 极方向移动
D. 阳极反应:$2HCHO - 2e^{-}+4OH^{-}\xlongequal{\;\;}2HCOO^{-}+2H_{2}O + H_{2}\uparrow$
答案:
A 命题点·电解原理,涉及电极反应式、离子移动方向判断、电化学计算等
**要点图解**:b极上${HCHO}$在碱性溶液中被氧化为${HCOO^{-}}$,则b极为阳极,该电池工作原理如下:
| |反应式|
| ---- | ---- |
|总反应|${2HCHO + 2OH^{-}\xlongequal{电解}2H_{2}\uparrow+ 2HCOO^{-}}$|
|阳极|${2HCHO - 2e^{-}+ 4OH^{-}=H_{2}\uparrow+ 2HCOO^{-}+ 2H_{2}O}$|
|阴极|${2H_{2}O + 2e^{-}=H_{2}\uparrow+ 2OH^{-}}$|
【解析】传统电解水制氢的反应为${2H_{2}O\xlongequal{电解}2H_{2}\uparrow+ O_{2}\uparrow}$,每转移$2\ \text{mol}$电子生成$1\ \text{mol}\ {H_{2}}$,根据要点图解,题图电解装置每转移$2\ \text{mol}$电子生成$2\ \text{mol}\ {H_{2}}$,相同电量下${H_{2}}$理论产量是传统电解水的2倍,A错误;阴极反应为水得电子生成${H_{2}}$和${OH^{-}}$,B正确;电解时,阴离子向阳极移动,所以${OH^{-}}$通过阴离子交换膜向b极方向移动,C正确;根据题中所给部分反应机理,每$1\ \text{mol}\ {HCHO}$被氧化为$1\ \text{mol}\ {HCOO^{-}}$转移$1\ \text{mol}$电子,同时生成$0.5\ \text{mol}\ {H_{2}}$,D正确。
4. [福建 2023·9,4 分]一种可在较高温下安全快充的铝 - 硫电池的工作原理如图,电解质为熔融氯铝酸盐(由 NaCl、KCl 和$AlCl_{3}$形成熔点为$93^{\circ}C$的共熔物),其中氯铝酸根$[Al_{n}Cl_{3n + 1}]^{-}(n\geqslant1)$起到结合或释放$Al^{3+}$的作用。电池总反应:$2Al + 3xS\underset{充电}{\overset{放电}{\rightleftharpoons }}Al_{2}(S_{x})_{3}$。下列说法错误的是( )
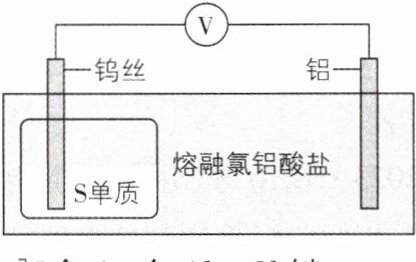
A. $[Al_{n}Cl_{3n + 1}]^{-}$含 4n 个$Al - Cl$键
B. $[Al_{n}Cl_{3n + 1}]^{-}$中同时连接 2 个 Al 原子的 Cl 原子有$(n - 1)$个
C. 充电时,再生 1 mol Al 单质至少转移 3 mol 电子
D. 放电时间越长,负极附近熔融盐中 n 值小的$[Al_{n}Cl_{3n + 1}]^{-}$浓度越高

A. $[Al_{n}Cl_{3n + 1}]^{-}$含 4n 个$Al - Cl$键
B. $[Al_{n}Cl_{3n + 1}]^{-}$中同时连接 2 个 Al 原子的 Cl 原子有$(n - 1)$个
C. 充电时,再生 1 mol Al 单质至少转移 3 mol 电子
D. 放电时间越长,负极附近熔融盐中 n 值小的$[Al_{n}Cl_{3n + 1}]^{-}$浓度越高
答案:
D 命题点·二次电池的工作原理,涉及物质结构、转移电子数目的计算等
**要点图解**:放电时,钨丝作正极,${S}$单质得电子后形成${S^{2 - }}$;放电时,铝电极作负极,铝失电子,成为${Al^{3 + }}$,进一步形成${[Al_{n}Cl_{3n + 1}]^{-}}$。
【解析】${[Al_{n}Cl_{3n + 1}]^{-}}$的结构为${Cl - Al - Cl}$(多个${Al}$相连,每个${Al}$连接4个${Cl}$),每个${Al}$原子上连接4个${Cl}$原子,所以${[Al_{n}Cl_{3n + 1}]^{-}}$含$4n$个${Al - Cl}$键,A正确;由${[Al_{n}Cl_{3n + 1}]^{-}}$的结构可知,同时连接2个${Al}$原子的${Cl}$原子有$(n - 1)$个,B正确;由总反应可知,充电时,再生$1\ \text{mol}\ {Al}$单质需由${Al^{3 + }}$得到电子生成,所以至少转移$3\ \text{mol}$电子,C正确;由总反应可知,放电时间越长,负极铝失去电子生成的${Al^{3 + }}$越多,${[Al_{n}Cl_{3n + 1}]^{-}}$结合的${Al^{3 + }}$越多,所以$n$值大的${[Al_{n}Cl_{3n + 1}]^{-}}$浓度越高,D错误。
5. [新课标 2024·12,6 分]一种可植入体内的微型电池工作原理如图所示,通过 CuO 催化消耗血糖发电,从而控制血糖浓度。当传感器检测到血糖浓度高于标准,电池启动。血糖浓度下降至标准,电池停止工作。(血糖浓度以葡萄糖浓度计)
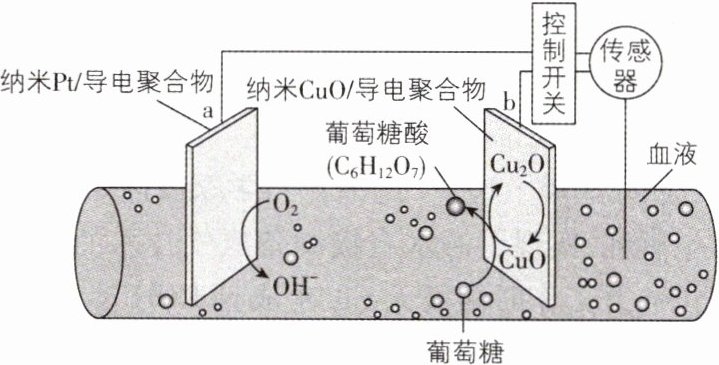
电池工作时,下列叙述错误的是( )
A. 电池总反应为$2C_{6}H_{12}O_{6}+O_{2}\xlongequal{\;\;}2C_{6}H_{12}O_{7}$
B. b 电极上 CuO 通过 Cu(Ⅱ)和 Cu(Ⅰ)相互转变起催化作用
C. 消耗 18 mg 葡萄糖,理论上 a 电极有 0.4 mmol 电子流入
D. 两电极间血液中的$Na^{+}$在电场驱动下的迁移方向为$b→a$

电池工作时,下列叙述错误的是( )
A. 电池总反应为$2C_{6}H_{12}O_{6}+O_{2}\xlongequal{\;\;}2C_{6}H_{12}O_{7}$
B. b 电极上 CuO 通过 Cu(Ⅱ)和 Cu(Ⅰ)相互转变起催化作用
C. 消耗 18 mg 葡萄糖,理论上 a 电极有 0.4 mmol 电子流入
D. 两电极间血液中的$Na^{+}$在电场驱动下的迁移方向为$b→a$
答案:
C 命题点·微型电池的工作原理
**信息梳理**
|电极|电极反应式|
| ---- | ---- |
|a电极|${O_{2}+ 4e^{-}+ 2H_{2}O = 4OH^{-}}$|
|b电极|${Cu_{2}O - 2e^{-}+ 2OH^{-}=2CuO + H_{2}O}$;${C_{6}H_{12}O_{6}+ 2CuO = C_{6}H_{12}O_{7}+ Cu_{2}O}$|
【解析】由题图知,${O_{2}}$在a电极上得电子生成${OH^{-}}$,a电极为电池正极,${Cu_{2}O}$在b电极上失电子转化成${CuO}$,b电极为电池负极,在负极区,葡萄糖被${CuO}$氧化为葡萄糖酸,${CuO}$被还原为${Cu_{2}O}$,则电池总反应为葡萄糖被${O_{2}}$氧化为葡萄糖酸,A正确;${Cu_{2}O}$在b电极上失电子转化成${CuO}$,${CuO}$氧化葡萄糖时被还原生成${Cu_{2}O}$,它们的相互转变起催化作用,B正确;根据反应${2C_{6}H_{12}O_{6}+ O_{2}=2C_{6}H_{12}O_{7}}$可知,$1\ \text{mol}\ {C_{6}H_{12}O_{6}}$参加反应时转移$2\ \text{mol}$电子,$18\ \text{mg}\ {C_{6}H_{12}O_{6}}$的物质的量为$0.1\ \text{mmol}$,则消耗$18\ \text{mg}$葡萄糖时,理论上a电极有$0.2\ \text{mmol}$电子流入,C错误;原电池中阳离子从负极移向正极,故${Na^{+}}$迁移方向为b→a,D正确。
查看更多完整答案,请扫码查看


