2025年高考必刷题高三化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年高考必刷题高三化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第49页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
7. [山东临沂 2024 二模]一种以$Pd - Cu$为催化剂还原去除水体中$NO_{3}^{-}$的机理如图甲所示;其他条件相同,pH 不同时,$NO_{3}^{-}$转化率和不同产物在总还原产物中所占的物质的量的百分比如图乙所示。

已知:溶液 pH 会影响 Pd 对$NO_{2}^{-}$的吸附,不影响对 H 的吸附。
下列说法不正确的是 ( )
A. pH 越小,Pd 对$NO_{2}^{-}$的吸附能力越强
B. 通过调节溶液的 pH,可使$NO_{3}^{-}$更多地转化为$N_{2}$
C. 反应ⅱ中生成$NH_{4}^{+}$的离子方程式为$NO_{2}^{-}+6H + 2H^{+}\xlongequal{\;\;}NH_{4}^{+}+2H_{2}O$
D. pH = 12 时,每处理 6.2 g $NO_{3}^{-}$,理论上消耗标准状况下 5.6 L $H_{2}$

已知:溶液 pH 会影响 Pd 对$NO_{2}^{-}$的吸附,不影响对 H 的吸附。
下列说法不正确的是 ( )
A. pH 越小,Pd 对$NO_{2}^{-}$的吸附能力越强
B. 通过调节溶液的 pH,可使$NO_{3}^{-}$更多地转化为$N_{2}$
C. 反应ⅱ中生成$NH_{4}^{+}$的离子方程式为$NO_{2}^{-}+6H + 2H^{+}\xlongequal{\;\;}NH_{4}^{+}+2H_{2}O$
D. pH = 12 时,每处理 6.2 g $NO_{3}^{-}$,理论上消耗标准状况下 5.6 L $H_{2}$
答案:
D 考查点·除去水体中$NO_{3}^{-}$的反应机理
【解析】由图乙可知,随着pH减小,还原产物中$N_{2}$百分比明显增大,氨态氮百分比变化不大,说明$Pd$表面吸附的$NO_{2}^{-}$个数比变大,即pH越小,$Pd$对$NO_{2}^{-}$的吸附能力越强,A正确;由图乙信息可知,pH不同还原产物也不同,pH为4时主要还原产物为$N_{2}$,pH为12时,还原产物几乎全是$NO_{2}^{-}$,故通过调节溶液的pH,可使$NO_{3}^{-}$更多地转化为$N_{2}$,B正确;由图甲可知,反应ⅱ即$NO_{2}^{-}$和$H$反应生成$N_{2}$或氨态氮,反应ⅱ中生成$NH_{4}^{+}$的离子方程式为$NO_{2}^{-}+6H + 2H^{+}=NH_{4}^{+}+2H_{2}O$,C正确;由图乙可知,pH = 12时,还原产物几乎全是$NO_{2}^{-}$,$NO_{3}^{-}$的物质的量为$\frac{6.2g}{62g\cdot mol^{-1}} = 0.1mol$,故每处理$6.2gNO_{3}^{-}$转移电子为$0.2mol$,根据得失电子守恒可知,理论上消耗标准状况下$H_{2}$的体积为$\frac{0.2mol}{2}\times22.4L\cdot mol^{-1}=2.24L$,D错误。
8. [湖南益阳 2024 月考]$BaTiO_{3}$是一种压电材料。以$BaSO_{4}$为原料,采用下列路线可制备粉状$BaTiO_{3}$。已知“焙烧”后固体产物有$BaCl_{2}$、易溶于水的 BaS 和微溶于水的 CaS;“沉淀”步骤中生成的沉淀化学式为$BaTiO(C_{2}O_{4})_{2}$。

下列说法中错误的是 ( )
A. “焙烧”步骤中碳粉的主要作用是作还原剂
B. “浸取”步骤中的滤渣为 CaS,“酸化”步骤中的酸可用盐酸或稀硫酸
C. “沉淀”步骤中发生反应的化学方程式为$BaCl_{2}+TiCl_{4}+2(NH_{4})_{2}C_{2}O_{4}+H_{2}O\xlongequal{\;\;}BaTiO(C_{2}O_{4})_{2}\downarrow + 4NH_{4}Cl + 2HCl$
D. “热分解”过程中产生的 CO 和$CO_{2}$的物质的量之比为 1:1
答题策略见 P401

下列说法中错误的是 ( )
A. “焙烧”步骤中碳粉的主要作用是作还原剂
B. “浸取”步骤中的滤渣为 CaS,“酸化”步骤中的酸可用盐酸或稀硫酸
C. “沉淀”步骤中发生反应的化学方程式为$BaCl_{2}+TiCl_{4}+2(NH_{4})_{2}C_{2}O_{4}+H_{2}O\xlongequal{\;\;}BaTiO(C_{2}O_{4})_{2}\downarrow + 4NH_{4}Cl + 2HCl$
D. “热分解”过程中产生的 CO 和$CO_{2}$的物质的量之比为 1:1
答题策略见 P401
答案:
B 突破点·工艺流程中的实验操作及物质的变化
思路导引 由流程和题中信息可知,$BaSO_{4}$与过量的碳粉及过量的氯化钙在高温下焙烧得到$CO$、$BaCl_{2}$、易溶于水的$BaS$和微溶于水的$CaS$;烧渣经水浸取后过滤,滤渣中主要有碳粉和$CaS$,滤液中溶质的主要成分为$BaS$和$BaCl_{2}$;滤液经酸化后浓缩结晶得到$BaCl_{2}$晶体;$BaCl_{2}$晶体溶于水后,加入$TiCl_{4}$和$(NH_{4})_{2}C_{2}O_{4}$将钡离子充分沉淀得到$BaTiO(C_{2}O_{4})_{2}$;$BaTiO(C_{2}O_{4})_{2}$经热分解得到$BaTiO_{3}$。
【解析】“焙烧”步骤中$BaSO_{4}$与过量的碳粉及过量的氯化钙在高温下焙烧得到$CO$、$BaCl_{2}$、易溶于水的$BaS$和微溶于水的$CaS$,C的化合价从0升高到 + 2,即碳粉的主要作用是作还原剂,A正确;由分析可知,“浸取”步骤中的滤渣为$CaS$和碳粉,“酸化”步骤中的酸可用盐酸,稀硫酸会与$Ba^{2 + }$反应生成$BaSO_{4}$沉淀,从而降低产品产率,B错误;“沉淀”步骤为$BaCl_{2}$晶体溶于水后,加入$TiCl_{4}$和$(NH_{4})_{2}C_{2}O_{4}$将钡离子充分沉淀得到$BaTiO(C_{2}O_{4})_{2}$,对应的化学方程式为$BaCl_{2}+TiCl_{4}+2(NH_{4})_{2}C_{2}O_{4}+H_{2}O = BaTiO(C_{2}O_{4})_{2}\downarrow + 4NH_{4}Cl + 2HCl$,C正确;$BaTiO(C_{2}O_{4})_{2}$经“热分解”得到$BaTiO_{3}$,对应的化学方程式为$BaTiO(C_{2}O_{4})_{2}\stackrel{\triangle}{=}BaTiO_{3}+2CO_{2}\uparrow + 2CO\uparrow$,$CO$和$CO_{2}$的物质的量之比为1:1,D正确。
9. [河南南阳 2024 一模]黄钠铁矾$[Na_{3}Fe_{3}(SO_{4})_{3}(OH)_{6}]$可用作净水剂。以工业废料铁泥(表面沾有油污,主要成分是$Fe_{2}O_{3}$,还含有 Fe、FeO、$SiO_{2}$)为原料制取黄钠铁矾的工艺流程如图所示。
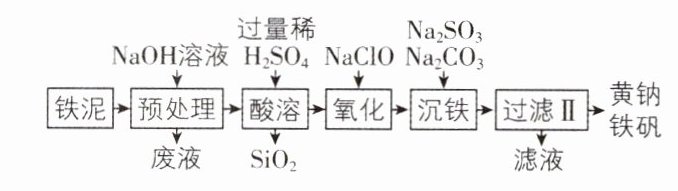
请回答下列问题:
(1)黄钠铁矾中 Fe 元素的化合价为____,预处理的主要目的是____。
(2)过滤操作用到的玻璃仪器有____、____和____。
(3)为提高“酸溶”浸取率,可采取的措施有____(填两种)。
(4)“氧化”过程的离子方程式为____,可以替代$NaClO$的常见试剂为____(填化学式,任写一种)。
(5)“沉铁”过程发生反应的离子方程式为____。
(6)检验滤液中不含氧元素的阴离子的方法是____。

请回答下列问题:
(1)黄钠铁矾中 Fe 元素的化合价为____,预处理的主要目的是____。
(2)过滤操作用到的玻璃仪器有____、____和____。
(3)为提高“酸溶”浸取率,可采取的措施有____(填两种)。
(4)“氧化”过程的离子方程式为____,可以替代$NaClO$的常见试剂为____(填化学式,任写一种)。
(5)“沉铁”过程发生反应的离子方程式为____。
(6)检验滤液中不含氧元素的阴离子的方法是____。
答案:
(1) + 3 除去铁泥表面的油污
(2)烧杯 漏斗 玻璃棒
(3)适当增大酸的浓度、加热、搅拌、延长时间等(任写两种)
(4)$2Fe^{2 + }+2H^{+}+ClO^{-}=2Fe^{3 + }+Cl^{-}+H_{2}O$ $H_{2}O_{2}$(或$Cl_{2}$、$O_{2}$,任写一种,合理即可)
(5)$3Fe^{3 + }+3Na^{+}+3SO_{4}^{2 - }+3CO_{3}^{2 - }+3H_{2}O = Na_{3}Fe_{3}(SO_{4})_{3}(OH)_{6}\downarrow + 3CO_{2}\uparrow$
(6)取少许滤液于试管中,向其中滴加稀硝酸酸化,再滴加硝酸银溶液,若有白色沉淀产生,则说明待测液中含有$Cl^{-}$ 创新点·制取黄钠铁矾的工艺流程分析 思路导引 预处理阶段加入$NaOH$溶液除去铁泥表面中的油污,然后加入稀硫酸,酸溶后的酸性溶液中含有$Fe^{2 + }$,过滤分离出的滤渣为$SiO_{2}$,加入$NaClO$将亚铁离子氧化成铁离子,再加入碳酸钠、硫酸钠溶液使铁离子全部沉淀生成黄钠铁矾。 【解析】
(4)根据分析可知,$NaClO$将亚铁离子氧化成铁离子,离子方程式为$2Fe^{2 + }+2H^{+}+ClO^{-}=2Fe^{3 + }+Cl^{-}+H_{2}O$;酸性条件下,$NaClO$具有强氧化性,可以将$Fe^{2 + }$氧化为$Fe^{3 + }$,在不引入杂质的前提下,可以用$H_{2}O_{2}$替代$NaClO$。
(5)“沉铁”过程硫酸钠、碳酸钠和$Fe^{3 + }$发生反应生成$Na_{3}Fe_{3}(SO_{4})_{3}(OH)_{6}$,发生反应的离子方程式为$3Fe^{3 + }+3Na^{+}+3SO_{4}^{2 - }+3CO_{3}^{2 - }+3H_{2}O = Na_{3}Fe_{3}(SO_{4})_{3}(OH)_{6}\downarrow + 3CO_{2}\uparrow$。
(6)根据流程可知,滤液中不含氧元素的阴离子为氯离子,检验氯离子的方法是取少许滤液于试管中,向其中滴加稀硝酸酸化,再滴加硝酸银溶液,若有白色沉淀产生,则说明待测液中含有$Cl^{-}$。
(1) + 3 除去铁泥表面的油污
(2)烧杯 漏斗 玻璃棒
(3)适当增大酸的浓度、加热、搅拌、延长时间等(任写两种)
(4)$2Fe^{2 + }+2H^{+}+ClO^{-}=2Fe^{3 + }+Cl^{-}+H_{2}O$ $H_{2}O_{2}$(或$Cl_{2}$、$O_{2}$,任写一种,合理即可)
(5)$3Fe^{3 + }+3Na^{+}+3SO_{4}^{2 - }+3CO_{3}^{2 - }+3H_{2}O = Na_{3}Fe_{3}(SO_{4})_{3}(OH)_{6}\downarrow + 3CO_{2}\uparrow$
(6)取少许滤液于试管中,向其中滴加稀硝酸酸化,再滴加硝酸银溶液,若有白色沉淀产生,则说明待测液中含有$Cl^{-}$ 创新点·制取黄钠铁矾的工艺流程分析 思路导引 预处理阶段加入$NaOH$溶液除去铁泥表面中的油污,然后加入稀硫酸,酸溶后的酸性溶液中含有$Fe^{2 + }$,过滤分离出的滤渣为$SiO_{2}$,加入$NaClO$将亚铁离子氧化成铁离子,再加入碳酸钠、硫酸钠溶液使铁离子全部沉淀生成黄钠铁矾。 【解析】
(4)根据分析可知,$NaClO$将亚铁离子氧化成铁离子,离子方程式为$2Fe^{2 + }+2H^{+}+ClO^{-}=2Fe^{3 + }+Cl^{-}+H_{2}O$;酸性条件下,$NaClO$具有强氧化性,可以将$Fe^{2 + }$氧化为$Fe^{3 + }$,在不引入杂质的前提下,可以用$H_{2}O_{2}$替代$NaClO$。
(5)“沉铁”过程硫酸钠、碳酸钠和$Fe^{3 + }$发生反应生成$Na_{3}Fe_{3}(SO_{4})_{3}(OH)_{6}$,发生反应的离子方程式为$3Fe^{3 + }+3Na^{+}+3SO_{4}^{2 - }+3CO_{3}^{2 - }+3H_{2}O = Na_{3}Fe_{3}(SO_{4})_{3}(OH)_{6}\downarrow + 3CO_{2}\uparrow$。
(6)根据流程可知,滤液中不含氧元素的阴离子为氯离子,检验氯离子的方法是取少许滤液于试管中,向其中滴加稀硝酸酸化,再滴加硝酸银溶液,若有白色沉淀产生,则说明待测液中含有$Cl^{-}$。
查看更多完整答案,请扫码查看


