2025年高考必刷题高三化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年高考必刷题高三化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第73页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
1. [浙江强基联盟2024联考]己二腈[$NC(CH_{2})_{4}CN$]是合成尼龙 - 66的中间体。某小组以浓差电池为电源,以丙烯腈$(CH_{2}=CHCN)$为原料,通过电解法合成己二腈的原理如图(铜电极质量均为100 g):

下列说法不正确的是 ( )
A. 铜电极(1)为原电池的正极,发生还原反应
B. 当甲室两电极质量差为6.4 g时,理论上可生成0.1 mol己二腈
C. 乙室可选用阳离子交换膜,$H^{+}$向左移动
D. 石墨电极(1)的电极反应式为$2CH_{2}=CHCN + 2H^{+}+2e^{-}=NC(CH_{2})_{4}CN$

下列说法不正确的是 ( )
A. 铜电极(1)为原电池的正极,发生还原反应
B. 当甲室两电极质量差为6.4 g时,理论上可生成0.1 mol己二腈
C. 乙室可选用阳离子交换膜,$H^{+}$向左移动
D. 石墨电极(1)的电极反应式为$2CH_{2}=CHCN + 2H^{+}+2e^{-}=NC(CH_{2})_{4}CN$
答案:
B 考查点:浓差电池、离子移动方向、电极反应式、电化学相关计算
**思路导引**:浓差电池中,根据甲室阴离子交换膜两侧溶液的浓度可知,Cu 电极
(2)作负极,电极反应式为$Cu - 2e^- = Cu^{2+}$,Cu 电极
(1)作正极,电极反应式为$Cu^{2+} + 2e^- = Cu$,则乙室中石墨电极
(1)为阴极、石墨电极
(2)为阳极,阳极上水失电子生成氧气和氢离子,电极反应式为$2H_2O - 4e^- = O_2↑ + 4H^+$,阴极上丙烯腈得电子生成己二腈,电极反应式为$2CH_2 = CHCN + 2H^+ + 2e^- = NC(CH_2)_4CN$。 **解析**:由思路导引可知,Cu 电极
(1)为正极,电极上发生得电子的还原反应,A 正确;当甲室两电极质量差为 6.4 g 时,Cu 电极
(1)、
(2)分别增加、减少 3.2 g(0.05 mol)Cu,转移电子的物质的量为 0.1 mol,由$2CH_2 = CHCN + 2H^+ + 2e^- = NC(CH_2)_4CN$可知,生成 0.05 mol 己二腈,B 错误;根据乙室阳极、阴极发生的反应,可知乙室应选用阳离子交换膜,$H^+$由阳极移向阴极,C 正确;石墨电极
(1)的电极反应式为$2CH_2 = CHCN + 2H^+ + 2e^- = NC(CH_2)_4CN$,D 正确。
(2)作负极,电极反应式为$Cu - 2e^- = Cu^{2+}$,Cu 电极
(1)作正极,电极反应式为$Cu^{2+} + 2e^- = Cu$,则乙室中石墨电极
(1)为阴极、石墨电极
(2)为阳极,阳极上水失电子生成氧气和氢离子,电极反应式为$2H_2O - 4e^- = O_2↑ + 4H^+$,阴极上丙烯腈得电子生成己二腈,电极反应式为$2CH_2 = CHCN + 2H^+ + 2e^- = NC(CH_2)_4CN$。 **解析**:由思路导引可知,Cu 电极
(1)为正极,电极上发生得电子的还原反应,A 正确;当甲室两电极质量差为 6.4 g 时,Cu 电极
(1)、
(2)分别增加、减少 3.2 g(0.05 mol)Cu,转移电子的物质的量为 0.1 mol,由$2CH_2 = CHCN + 2H^+ + 2e^- = NC(CH_2)_4CN$可知,生成 0.05 mol 己二腈,B 错误;根据乙室阳极、阴极发生的反应,可知乙室应选用阳离子交换膜,$H^+$由阳极移向阴极,C 正确;石墨电极
(1)的电极反应式为$2CH_2 = CHCN + 2H^+ + 2e^- = NC(CH_2)_4CN$,D 正确。
2. [湖南长沙雅礼中学2024月考]如图是一种正在投入生产的大型蓄电系统。左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许离子通过;放电前,被膜隔开的电解质为$Na_{2}S_{2}$和$NaBr_{3}$,放电后,分别变为$Na_{2}S_{4}$和$NaBr$。下列有关该系统的叙述不正确的是 ( )
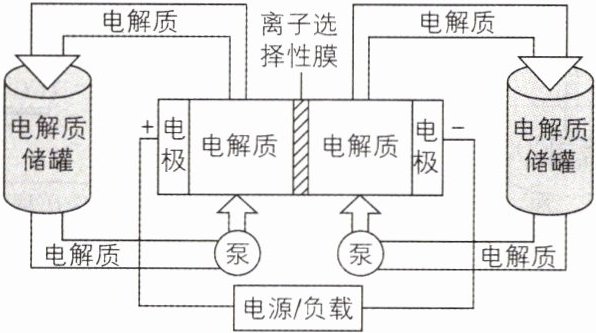
A. 左、右储罐中的电解质分别为$NaBr_{3}/NaBr$、$Na_{2}S_{2}/Na_{2}S_{4}$
B. 中间的离子选择性膜为阴离子交换膜,允许阴离子通过
C. 电池充电时,阴极的电极反应式为$S_{4}^{2 - }+2e^{-}=2S_{2}^{2 - }$
D. 用该电池(电极为惰性电极)电解硫酸铜溶液一段时间后,需往溶液中加入0.3 mol $Cu_{2}(OH)_{2}CO_{3}$才能使原硫酸铜溶液复原,则电解过程中转移电子的物质的量为1.8 mol

A. 左、右储罐中的电解质分别为$NaBr_{3}/NaBr$、$Na_{2}S_{2}/Na_{2}S_{4}$
B. 中间的离子选择性膜为阴离子交换膜,允许阴离子通过
C. 电池充电时,阴极的电极反应式为$S_{4}^{2 - }+2e^{-}=2S_{2}^{2 - }$
D. 用该电池(电极为惰性电极)电解硫酸铜溶液一段时间后,需往溶液中加入0.3 mol $Cu_{2}(OH)_{2}CO_{3}$才能使原硫酸铜溶液复原,则电解过程中转移电子的物质的量为1.8 mol
答案:
B 考查点:二次电池工作原理及相关计算、离子交换膜类型判断
**解析**:放电前,被膜隔开的电解质为$Na_2S_2$和$NaBr_3$,放电后,分别变为$Na_2S_4$和$NaBr$,$Na_2S_2→Na_2S_4$为氧化反应,$NaBr_3→NaBr$为还原反应,放电时左侧电极为正极,发生还原反应,则左侧储罐中的电解质为$NaBr_3/NaBr$,右侧电极为负极,发生氧化反应,则右侧储罐中的电解质为$Na_2S_2/Na_2S_4$,A 正确;电池充电时,阳极发生氧化反应,电极反应式为$3Br^- - 2e^- = Br_3^-$,阴极发生还原反应,电极反应式为$S_4^{2-} + 2e^- = 2S_2^{2-}$,阳极的$Na^+$要经过阳离子交换膜进入阴极,中间的离子选择性膜为阳离子交换膜,B 错误,C 正确;用该电池(电极为惰性电极)电解硫酸铜溶液,阳极反应式为$2H_2O - 4e^- = O_2↑ + 4H^+$,阴极电极反应式为$Cu^{2+} + 2e^- = Cu$、$2H^+ + 2e^- = H_2↑$($Cu^{2+}$消耗完后),一段时间后需往溶液中加入 0.3 mol $Cu_2(OH)_2CO_3$才能使原硫酸铜溶液复原,根据铜原子和氢原子守恒,可知阴极析出 0.6 mol Cu 和 0.3 mol $H_2$,共转移 1.8 mol 电子,D 正确。
3. [山东省实验中学2024月考]碱性锌铁液流电池具有电压高、成本低的优点。该电池的总反应为$Zn + 2[Fe(CN)_{6}]^{3 - }+4OH^{-}\underset{充电}{\overset{放电}{\rightleftharpoons }}2[Fe(CN)_{6}]^{4 - }+[Zn(OH)_{4}]^{2 - }$,下列叙述不正确的是 ( )
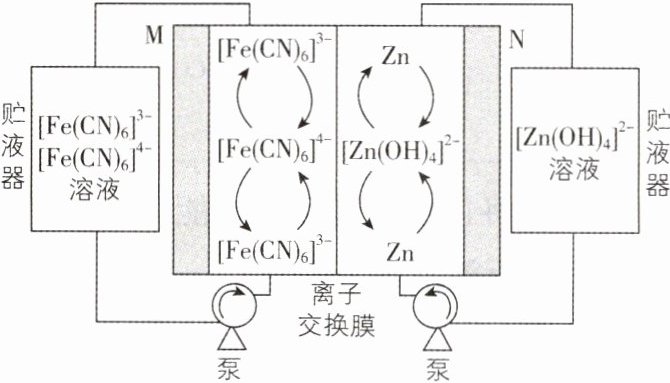
A. 放电时,N极电势高于M极
B. 充电时,右侧贮液器中溶液浓度减小
C. 若离子交换膜只有$OH^{-}$通过,1 mol $[Fe(CN)_{6}]^{3 - }$反应时,有1 mol $OH^{-}$通过离子交换膜
D. 放电时,N极反应式为$Zn - 2e^{-}+4OH^{-}=[Zn(OH)_{4}]^{2 - }$

A. 放电时,N极电势高于M极
B. 充电时,右侧贮液器中溶液浓度减小
C. 若离子交换膜只有$OH^{-}$通过,1 mol $[Fe(CN)_{6}]^{3 - }$反应时,有1 mol $OH^{-}$通过离子交换膜
D. 放电时,N极反应式为$Zn - 2e^{-}+4OH^{-}=[Zn(OH)_{4}]^{2 - }$
答案:
A 考查点:碱性锌铁液流电池工作原理及相关计算、电极反应式的书写
**思路导引**:由图可知:碱性锌铁液流电池放电时,右侧 N 极为负极,Zn 发生失电子的氧化反应生成$[Zn(OH)_4]^{2-}$,负极反应式为$Zn - 2e^- + 4OH^- = [Zn(OH)_4]^{2-}$;左侧 M 极为正极,正极上发生得电子的还原反应,正极反应式为$[Fe(CN)_6]^{3-} + e^- = [Fe(CN)_6]^{4-}$。充电时 M 极为阳极,N 极为阴极。
**解析**:根据思路导引可知,放电时,右侧 N 极为负极,左侧 M 极为正极,则 N 电极电势低于 M 极,A 错误;充电时,右侧电极反应式为$[Zn(OH)_4]^{2-} + 2e^- = Zn + 4OH^-$,则$[Zn(OH)_4]^{2-}$浓度降低,B 正确;在放电时,M 极为正极,发生反应为$[Fe(CN)_6]^{3-} + e^- = [Fe(CN)_6]^{4-}$,当左侧 M 电极有 1 mol $[Fe(CN)_6]^{3-}$发生反应时,左侧负电荷数目会增加 1 mol,为维持电荷守恒,就会有 1 mol $OH^-$通过离子交换膜移向 N 极,C 正确;放电时该装置为原电池,N 极为原电池的负极,电极反应式为$Zn - 2e^- + 4OH^- = [Zn(OH)_4]^{2-}$,D 正确。
4. [重庆云阳2024阶段练习]一种新型电池装置如图所示。金刚石压砧把$H_{2}$压入储氢材料,在压力梯度的驱动下生成质子,电子先后通过下层Pt电极和外接线路转移到Pd电极参与反应,形成闭合回路。下列说法正确的是 ( )
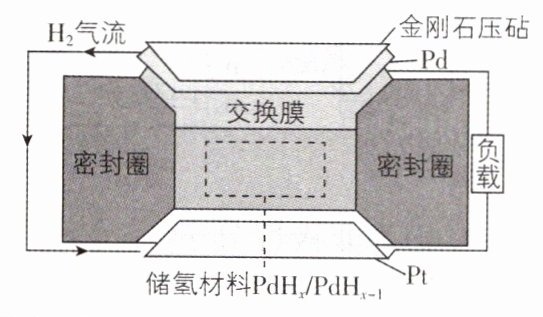
A. Pd电极发生的反应是氧化反应
B. 电流方向是Pt电极→负载→Pd电极→交换膜→Pt电极
C. 电池的负极反应式为$PdH_{x}-e^{-}=PdH_{x - 1}+H^{+}$
D. 由于压力梯度,Pt电极的电势会高于Pd电极的电势

A. Pd电极发生的反应是氧化反应
B. 电流方向是Pt电极→负载→Pd电极→交换膜→Pt电极
C. 电池的负极反应式为$PdH_{x}-e^{-}=PdH_{x - 1}+H^{+}$
D. 由于压力梯度,Pt电极的电势会高于Pd电极的电势
答案:
C 创新点:新型电池、原电池电子流向判断及应用
**解析**:在压力梯度的驱动下,储氢材料处生成的质子($H^+$)通过交换膜移向 Pd 电极,外电路电子流动方向为 Pt 电极→负载→Pd 电极,故 Pd 电极为正极,Pt 电极为负极,则 Pd 电极发生还原反应,A 错误;电流方向为 Pd 电极→负载→Pt 电极→交换膜→Pd 电极,B 错误;电池的负极反应式为$PdH_x - e^- = PdH_{x - 1} + H^+$,C 正确;Pd 电极为正极,则 Pt 电极的电势低于 Pd 电极的电势,D 错误。
查看更多完整答案,请扫码查看


