2025年高考必刷题高三化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年高考必刷题高三化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第63页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
1. [重庆七中2024月考]$NH_{3}$是潜在的储氢载体,利用光伏电池电解氨制备氢气的装置如图所示。下列说法错误的是 ( )
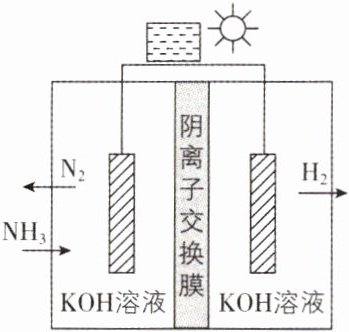
A. 能量转化:太阳能→电能→化学能
B. 生成2 g $H_{2}$时,有2 mol $OH^{-}$由交换膜右侧迁移至左侧
C. 阳极反应式为$2NH_{3}+6OH^{-}-6e^{-}\xlongequal{\;\;}N_{2}+6H_{2}O$
D. 电解一段时间后,交换膜两侧溶液pH都一定不变

A. 能量转化:太阳能→电能→化学能
B. 生成2 g $H_{2}$时,有2 mol $OH^{-}$由交换膜右侧迁移至左侧
C. 阳极反应式为$2NH_{3}+6OH^{-}-6e^{-}\xlongequal{\;\;}N_{2}+6H_{2}O$
D. 电解一段时间后,交换膜两侧溶液pH都一定不变
答案:
D 考查点:电解原理、电极反应式的书写及相关计算、电解质溶液pH变化
【解析】光伏电池可将太阳能转化为电能,再通过电解将电能转化为化学能,A正确;电解池右侧是阴极,水放电产生氢气,每产生2g(即1mol)氢气,转移2mol电子,生成2mol氢氧根离子由交换膜右侧迁移至左侧,B正确;电解池左侧是阳极,氨气在碱性条件下失去电子,电极反应式为$2NH_{3}+6OH^{-}-6e^{-}=N_{2}+6H_{2}O$,C正确;阳极生成了$H_{2}O$,pH减小,阴极消耗了$H_{2}O$,pH增大,D错误。
2. [辽宁沈阳二中2024期中]利用电膜技术,以$Na_{2}CrO_{4}$为原料制备$Na_{2}Cr_{2}O_{7}$,装置如图所示。下列说法错误的是 ( )
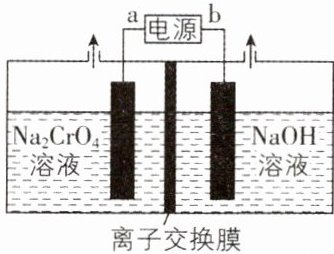
A. 电路中每转移2 mol $e^{-}$,就有2 mol $Na^{+}$通过离子交换膜
B. b为电源正极
C. 总反应的化学方程式为$4Na_{2}CrO_{4}+4H_{2}O\xlongequal{电解}2Na_{2}Cr_{2}O_{7}+4NaOH+2H_{2}\uparrow +O_{2}\uparrow$
D. 电解一段时间后,阴极区pH增大

A. 电路中每转移2 mol $e^{-}$,就有2 mol $Na^{+}$通过离子交换膜
B. b为电源正极
C. 总反应的化学方程式为$4Na_{2}CrO_{4}+4H_{2}O\xlongequal{电解}2Na_{2}Cr_{2}O_{7}+4NaOH+2H_{2}\uparrow +O_{2}\uparrow$
D. 电解一段时间后,阴极区pH增大
答案:
B 考查点:电解原理、电极反应式的书写及相关计算、电解质溶液pH变化
【思路导引】反应原理为$2CrO_{4}^{2 - }+2H^{+}\rightleftharpoons Cr_{2}O_{7}^{2 - }+H_{2}O$,该电解池实质上就是电解水;a是正极,装置左侧是阳极,产生大量的氢离子和氧气;b是负极,装置右侧是阴极,产生氢气和$OH^{-}$;离子交换膜是阳离子交换膜,钠离子从左侧进入右侧。
【解析】根据电荷守恒可知,电路中转移多少电子,就有带等量电荷的钠离子通过离子交换膜,A正确;根据思路导引可知,b为电源负极,B错误;阳极反应式为①$2H_{2}O - 4e^{-}=O_{2}\uparrow + 4H^{+}$,在阳极还发生的反应为②$2CrO_{4}^{2 - }+2H^{+}\rightleftharpoons Cr_{2}O_{7}^{2 - }+H_{2}O$,阴极反应式为③$2H_{2}O + 2e^{-}=2OH^{-}+H_{2}\uparrow$,该过程总反应的离子方程式为① + ②×2 + ③×2得$4CrO_{4}^{2 - }+4H_{2}O\xlongequal{电解}2Cr_{2}O_{7}^{2 - }+4OH^{-}+2H_{2}\uparrow +O_{2}\uparrow$,改写成化学方程式为$4Na_{2}CrO_{4}+4H_{2}O\xlongequal{电解}2Na_{2}Cr_{2}O_{7}+4NaOH + 2H_{2}\uparrow +O_{2}\uparrow$,C正确;结合C项分析,电解过程阴极区产生大量的$OH^{-}$,溶液碱性增强,pH增大,D正确。
3. [四川成都七中2024期中]利用电化学原理控制反应条件能将$CO_{2}$电催化还原为$HCOOH$,电解过程中还伴随着析氢反应,反应过程的原理示意图如图,下列有关说法正确的是 ( )
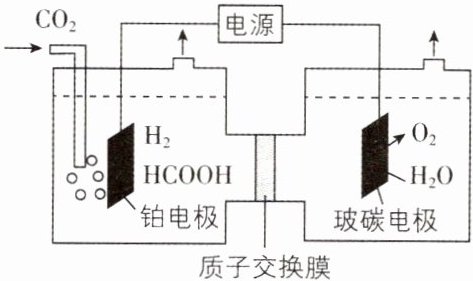
A. 玻碳电极发生还原反应
B. 铂电极发生的电极反应之一为$CO_{2}+2e^{-}+2H^{+}\xlongequal{\;\;}HCOOH$
C. 电池工作时,电子由玻碳电极经电解质溶液到铂电极
D. 当电路中转移1 mol $e^{-}$时,阳极室溶液的质量减少8 g

A. 玻碳电极发生还原反应
B. 铂电极发生的电极反应之一为$CO_{2}+2e^{-}+2H^{+}\xlongequal{\;\;}HCOOH$
C. 电池工作时,电子由玻碳电极经电解质溶液到铂电极
D. 当电路中转移1 mol $e^{-}$时,阳极室溶液的质量减少8 g
答案:
B 考查点:电解原理、电极反应式的书写及相关计算
【思路导引】由图可知,铂电极为电解池的阴极,酸性溶液中,氢离子和二氧化碳在阴极得到电子分别生成氢气和甲酸,电极反应式分别为$2H^{+}+2e^{-}=H_{2}\uparrow$、$CO_{2}+2H^{+}+2e^{-}=HCOOH$;玻碳电极为电解池的阳极,水分子在阳极失去电子,发生氧化反应生成氧气和氢离子,电极反应式为$2H_{2}O - 4e^{-}=O_{2}\uparrow + 4H^{+}$。
【解析】由思路导引可知,玻碳电极为阳极,水分子在阳极失去电子,发生氧化反应生成氧气和氢离子,A错误;由思路导引可知,B正确;电池工作时,电解质溶液不能传递电子,且电子应由电源负极传递到铂电极,C错误;当电路中转移1mol电子时,产生$\frac{1}{4}$mol的$O_{2}$,同时有1mol氢离子通过质子交换膜进入阴极室,则阳极室溶液的质量减少$1mol×\frac{1}{4}×32g·mol^{-1}+1mol×1g·mol^{-1}=9g$,D错误。
4. [福建福州2024联考]硝酸盐电解还原生成氨是实现硝酸盐废水资源化利用的有效途径。一种双室电解法电解硝酸盐酸性废水生成$NH_{3}$的装置如图所示,P、Q均连接惰性电极,下列说法不正确的是 ( )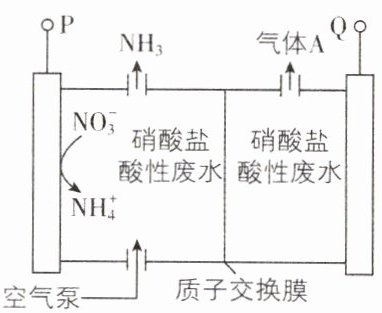
A. P连接外接电源的负极
B. 电解一段时间后,左室溶液的pH将减小
C. 生成的$NH_{3}$与气体A可作为硝酸工业的原料
D. 理论上每转化1 mol $NO_{3}^{-}$时,有8 mol $H^{+}$通过质子交换膜

A. P连接外接电源的负极
B. 电解一段时间后,左室溶液的pH将减小
C. 生成的$NH_{3}$与气体A可作为硝酸工业的原料
D. 理论上每转化1 mol $NO_{3}^{-}$时,有8 mol $H^{+}$通过质子交换膜
答案:
B 考查点:电解原理、电解质溶液pH变化
【思路导引】根据电解装置图可知,左侧物质由$NO_{3}^{-}$生成$NH_{4}^{+}$与$NH_{3}$,N元素化合价由 + 5降低到 - 3,发生还原反应,为阴极,与电源负极相连,电极反应式为$2NO_{3}^{-}+16e^{-}+19H^{+}=NH_{3}\uparrow +NH_{4}^{+}+6H_{2}O$,右侧为阳极,与电源正极相连,发生氧化反应,电极反应式为$2H_{2}O - 4e^{-}=O_{2}\uparrow + 4H^{+}$。
【解析】由思路导引可知,左侧为阴极,则P连接外接电源的负极,A正确;由思路导引可知,当有2mol$NO_{3}^{-}$被还原时,左侧消耗氢离子19mol,同时有16mol氢离子移向左侧,因此左侧酸性减弱,pH增大,B错误;由思路导引可知,A为氧气,工业可用氨的催化氧化等流程制备硝酸,C正确;氢离子通过质子交换膜流向阴极,根据反应式,有关系为$2NO_{3}^{-}~16e^{-}$,同时阳极产生16mol氢离子通过质子交换膜,则理论上每转化1mol$NO_{3}^{-}$时,有8mol$H^{+}$通过质子交换膜,D正确。
5. [黑龙江大庆2024一模]在强碱中氢氧化铁可被一些氧化剂氧化为高铁酸根离子($FeO_{4}^{2 - }$),$FeO_{4}^{2 - }$在酸性条件下氧化性极强且不稳定。采用隔膜电解法制备$K_{2}FeO_{4}$的工作原理如图所示。下列说法错误的是 ( )

A. 隔膜为阳离子交换膜
B. 由于阴极区产KOH,故电解过程中不需要额外补充
C. Fe电极上发生的反应为$Fe - 6e^{-}+8OH^{-}\xlongequal{\;\;}FeO_{4}^{2 - }+4H_{2}O$
D. 电路中每转移0.2 mol $e^{-}$,Pt电极上理论上产生2.24 L气体(标准状况)

A. 隔膜为阳离子交换膜
B. 由于阴极区产KOH,故电解过程中不需要额外补充
C. Fe电极上发生的反应为$Fe - 6e^{-}+8OH^{-}\xlongequal{\;\;}FeO_{4}^{2 - }+4H_{2}O$
D. 电路中每转移0.2 mol $e^{-}$,Pt电极上理论上产生2.24 L气体(标准状况)
答案:
B 考查点:离子交换膜、电极反应式、电解池有关的计算
【思路导引】该装置为电解池,与直流电源正极相连的Fe作阳极,碱性条件下,铁失去电子发生氧化反应生成高铁酸根离子,电极反应式为$Fe - 6e^{-}+8OH^{-}=FeO_{4}^{2 - }+4H_{2}O$,Pt作阴极,水在阴极处得到电子发生还原反应生成氢气和氢氧根离子,电极反应式为$2H_{2}O + 2e^{-}=2OH^{-}+H_{2}\uparrow$,电解的总反应为$Fe + 2H_{2}O + 2OH^{-}=FeO_{4}^{2 - }+3H_{2}\uparrow$,则电解时,钾离子通过阳离子交换膜从左向右移动。
【解析】由思路导引可知,隔膜为阳离子交换膜,A正确;由思路导引可知,电解的总反应为$Fe + 2H_{2}O + 2OH^{-}=FeO_{4}^{2 - }+3H_{2}\uparrow$,总反应中消耗氢氧根离子,故需要补充KOH,B错误;由思路导引可知,Fe电极上发生的反应为$Fe - 6e^{-}+8OH^{-}=FeO_{4}^{2 - }+4H_{2}O$,C正确;Pt电极的电极反应式为$2H_{2}O + 2e^{-}=2OH^{-}+H_{2}\uparrow$,电路中每转移0.2mol$e^{-}$,产生0.1mol$H_{2}$,标准状况下的体积为2.24L,D正确。
查看更多完整答案,请扫码查看


