2025年高考必刷题高三化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年高考必刷题高三化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第25页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
5. [湖北名校联盟2024联考]过氧化氢(H₂O₂)是一种绿色氧化剂。为了方便贮存、运输,工业上将其转化为固态过碳酸钠(2Na₂CO₃·3H₂O₂),该物质具有Na₂CO₃与H₂O₂的双重性质,可用作无毒漂白剂和供氧剂。制备过碳酸钠的工艺流程如图所示:

回答下列问题:
(1)一定条件下,“反应Ⅱ”的化学方程式为____________________。
(2)加入NaCl的作用是____________________。
(3)得到过碳酸钠粗品后,经过滤、洗涤、干燥得到产品,证明产品洗涤干净的操作是____________________。
(4)为测定产品纯度,称量m g产品并配制成250 mL溶液,量取25.00 mL该溶液于锥形瓶中,用0.100 mol·L⁻¹的酸性KMnO₄溶液滴定,重复三次实验,平均消耗V mL酸性KMnO₄溶液,则产品纯度为__________(用m、V表示)。
(5)过硼酸钠晶体(NaBO₃·4H₂O)也可用作漂白剂,加热至70℃以上会逐步失去结晶水。实验测得过硼酸钠晶体的质量随温度变化的曲线如图所示,则T₂~T₃℃所对应的化学方程式为____________________。


回答下列问题:
(1)一定条件下,“反应Ⅱ”的化学方程式为____________________。
(2)加入NaCl的作用是____________________。
(3)得到过碳酸钠粗品后,经过滤、洗涤、干燥得到产品,证明产品洗涤干净的操作是____________________。
(4)为测定产品纯度,称量m g产品并配制成250 mL溶液,量取25.00 mL该溶液于锥形瓶中,用0.100 mol·L⁻¹的酸性KMnO₄溶液滴定,重复三次实验,平均消耗V mL酸性KMnO₄溶液,则产品纯度为__________(用m、V表示)。
(5)过硼酸钠晶体(NaBO₃·4H₂O)也可用作漂白剂,加热至70℃以上会逐步失去结晶水。实验测得过硼酸钠晶体的质量随温度变化的曲线如图所示,则T₂~T₃℃所对应的化学方程式为____________________。

答案:
(1) 2Na₂CO₃ + 3H₂O₂ 一定条件= 2Na₂CO₃·3H₂O₂↓
(2) 降低2Na₂CO₃·3H₂O₂的溶解度,便于晶体析出
(3) 取少量最后一次洗涤液于另一支试管中,加入稀硝酸酸化,再加入硝酸银溶液,若溶液不变浑浊,则沉淀已洗净
(4) 157V/6m%
(5) NaBO₃·3H₂O △= NaBO₃·H₂O + 2H₂O 突破点·工艺流程中的钠的化合物 【解析】饱和食盐水中通入NH₃和CO₂,发生反应NaCl + H₂O + NH₃ + CO₂ = NaHCO₃↓ + NH₄Cl,过滤得到NaHCO₃固体,将其高温煅烧,发生分解反应2NaHCO₃ △= Na₂CO₃ + CO₂↑ + H₂O,将得到的Na₂CO₃溶解,加入H₂O₂、NaCl和稳定剂发生“反应Ⅱ”,得到产品2Na₂CO₃·3H₂O₂。
(1) Na₂CO₃溶液中加入H₂O₂、NaCl和稳定剂发生“反应Ⅱ”,得到产品2Na₂CO₃·3H₂O₂,化学方程式为2Na₂CO₃ + 3H₂O₂ 一定条件= 2Na₂CO₃·3H₂O₂↓。
(2) 加入NaCl的作用是降低2Na₂CO₃·3H₂O₂的溶解度,便于晶体析出。
(3) 过碳酸钠粗品表面易附着Cl⁻,故证明沉淀洗涤干净可检验最后一次洗涤液中无Cl⁻,操作为取少量最后一次洗涤液于另一支试管中,加入稀硝酸酸化,再加入硝酸银溶液,若溶液不变浑浊,则沉淀已洗净。
(4) 根据得失电子守恒,可得到反应的关系式5(2Na₂CO₃·3H₂O₂) ~ 6KMnO₄,故n(2Na₂CO₃·3H₂O₂)=5/6n(KMnO₄)=5/6×0.1×V×10⁻³×250/25 mol = 5/6V×10⁻³ mol,产品纯度为(5/6V×10⁻³×314)/m×100% = 157V/6m%。
(5) 30.8 g NaBO₃·4H₂O的物质的量为30.8g÷154g·mol⁻¹ = 0.2 mol,T₂℃时,失去的结晶水质量为30.8 g - 27.2 g = 3.6 g,物质的量为0.2 mol,所得晶体为NaBO₃·3H₂O,T₂ ~ T₃℃失去的结晶水质量为27.2 g - 20 g = 7.2 g,物质的量为0.4 mol,剩余的晶体为NaBO₃·H₂O,所以T₂ ~ T₃℃所对应的化学方程式为NaBO₃·3H₂O △= NaBO₃·H₂O + 2H₂O。
(1) 2Na₂CO₃ + 3H₂O₂ 一定条件= 2Na₂CO₃·3H₂O₂↓
(2) 降低2Na₂CO₃·3H₂O₂的溶解度,便于晶体析出
(3) 取少量最后一次洗涤液于另一支试管中,加入稀硝酸酸化,再加入硝酸银溶液,若溶液不变浑浊,则沉淀已洗净
(4) 157V/6m%
(5) NaBO₃·3H₂O △= NaBO₃·H₂O + 2H₂O 突破点·工艺流程中的钠的化合物 【解析】饱和食盐水中通入NH₃和CO₂,发生反应NaCl + H₂O + NH₃ + CO₂ = NaHCO₃↓ + NH₄Cl,过滤得到NaHCO₃固体,将其高温煅烧,发生分解反应2NaHCO₃ △= Na₂CO₃ + CO₂↑ + H₂O,将得到的Na₂CO₃溶解,加入H₂O₂、NaCl和稳定剂发生“反应Ⅱ”,得到产品2Na₂CO₃·3H₂O₂。
(1) Na₂CO₃溶液中加入H₂O₂、NaCl和稳定剂发生“反应Ⅱ”,得到产品2Na₂CO₃·3H₂O₂,化学方程式为2Na₂CO₃ + 3H₂O₂ 一定条件= 2Na₂CO₃·3H₂O₂↓。
(2) 加入NaCl的作用是降低2Na₂CO₃·3H₂O₂的溶解度,便于晶体析出。
(3) 过碳酸钠粗品表面易附着Cl⁻,故证明沉淀洗涤干净可检验最后一次洗涤液中无Cl⁻,操作为取少量最后一次洗涤液于另一支试管中,加入稀硝酸酸化,再加入硝酸银溶液,若溶液不变浑浊,则沉淀已洗净。
(4) 根据得失电子守恒,可得到反应的关系式5(2Na₂CO₃·3H₂O₂) ~ 6KMnO₄,故n(2Na₂CO₃·3H₂O₂)=5/6n(KMnO₄)=5/6×0.1×V×10⁻³×250/25 mol = 5/6V×10⁻³ mol,产品纯度为(5/6V×10⁻³×314)/m×100% = 157V/6m%。
(5) 30.8 g NaBO₃·4H₂O的物质的量为30.8g÷154g·mol⁻¹ = 0.2 mol,T₂℃时,失去的结晶水质量为30.8 g - 27.2 g = 3.6 g,物质的量为0.2 mol,所得晶体为NaBO₃·3H₂O,T₂ ~ T₃℃失去的结晶水质量为27.2 g - 20 g = 7.2 g,物质的量为0.4 mol,剩余的晶体为NaBO₃·H₂O,所以T₂ ~ T₃℃所对应的化学方程式为NaBO₃·3H₂O △= NaBO₃·H₂O + 2H₂O。
6. [四川攀枝花七中2024四诊]叠氮化钠(NaN₃)是一种防腐剂和分析试剂,在有机合成和汽车行业也有重要应用。某学习小组对叠氮化钠的制备和产品纯度测定进行相关探究。
查阅资料:
Ⅰ.氨基钠(NaNH₂)熔点为208℃,易潮解、易被氧化;N₂O有强氧化性,不与酸、碱反应;叠氮酸(HN₃)不稳定,易分解爆炸。
Ⅱ.2HNO₃+8HCl+4SnCl₂4SnCl₄+5H₂O+N₂O↑,2NaNH₂+N₂O△Na₃N+NaOH+NH₃。
回答下列问题:
(1)制备NaN₃
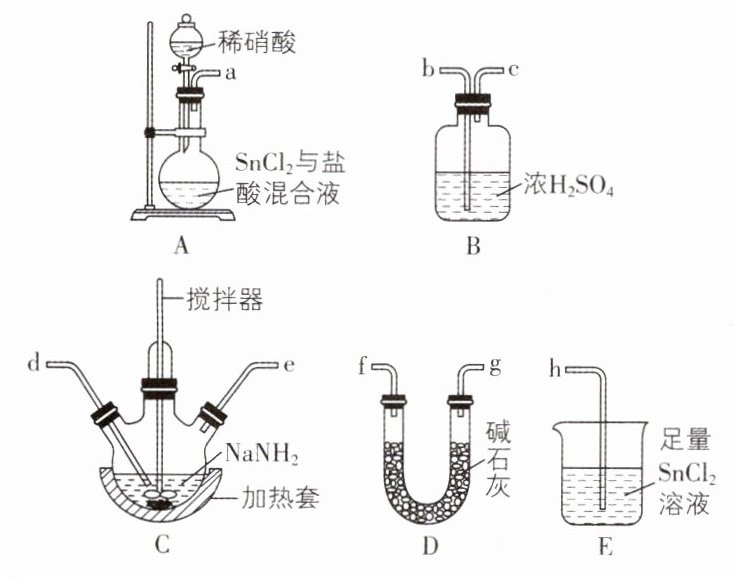
①按气流方向,上述装置合理的连接顺序为a→____→____→____→____→b→c→h(填仪器接口字母)。
②D的作用为____________________。
③实验时E中生成N₂和SnO₂·xH₂O沉淀,反应的化学方程式为____________________。
④C处充分反应后,停止加热,需进行的操作为____________________,其目的为____________________。
(2)用如图所示装置测定产品纯度(反应原理为ClO⁻+2N₃⁻+H₂OCl⁻+3N₂↑+2OH⁻)

①仪器F的名称为____________;
②管q的作用为____________________。
③若G的初始读数为37.20 mL、末读数为1.20 mL,本实验条件下气体摩尔体积为Vm L·mol⁻¹,则产品中NaN₃的质量分数为__________。
查阅资料:
Ⅰ.氨基钠(NaNH₂)熔点为208℃,易潮解、易被氧化;N₂O有强氧化性,不与酸、碱反应;叠氮酸(HN₃)不稳定,易分解爆炸。
Ⅱ.2HNO₃+8HCl+4SnCl₂4SnCl₄+5H₂O+N₂O↑,2NaNH₂+N₂O△Na₃N+NaOH+NH₃。
回答下列问题:
(1)制备NaN₃

①按气流方向,上述装置合理的连接顺序为a→____→____→____→____→b→c→h(填仪器接口字母)。
②D的作用为____________________。
③实验时E中生成N₂和SnO₂·xH₂O沉淀,反应的化学方程式为____________________。
④C处充分反应后,停止加热,需进行的操作为____________________,其目的为____________________。
(2)用如图所示装置测定产品纯度(反应原理为ClO⁻+2N₃⁻+H₂OCl⁻+3N₂↑+2OH⁻)

①仪器F的名称为____________;
②管q的作用为____________________。
③若G的初始读数为37.20 mL、末读数为1.20 mL,本实验条件下气体摩尔体积为Vm L·mol⁻¹,则产品中NaN₃的质量分数为__________。
答案:
(1) ①f(或g) g(或f) d e ②吸收N₂O中混有的HNO₃、HCl和水蒸气 ③SnCl₂ + N₂O + (x + 1)H₂O = SnO₂·xH₂O↓ + N₂ + 2HCl ④继续通入N₂至三颈烧瓶冷却后,关闭分液漏斗活塞 防止B中液体倒吸入C中,E中液体倒吸入B中
(2) ①蒸馏烧瓶 ②减小测定气体体积时的误差、使恒压滴液漏斗中的液体顺利流下 ③156/mVₘ% 突破点·实验题中钠的化合物的性质探究及其制备 【解析】装置A中稀硝酸和SnCl₂与盐酸的混合液反应制备N₂O,由于HNO₃和HCl具有挥发性且HNO₃具有强氧化性,故所制N₂O中混有HNO₃(g)、HCl(g)和H₂O(g),而NaNH₂易潮解、易被氧化,装置D中碱石灰可吸收N₂O中混有的HNO₃(g)、HCl(g)和H₂O(g),装置C中NaNH₂与N₂O共热发生反应制备NaN₃,装置B中浓硫酸可防止E中H₂O(g)进入装置C中,同时吸收装置C中反应生成的NH₃,最后用足量SnCl₂溶液吸收多余的N₂O。
(1) ①根据上述分析,按气流方向,装置的合理连接顺序为a→f(g)→g(f)→d→e→b→c→h。②由分析可知,装置D中碱石灰用于吸收N₂O中混有的HNO₃(g)、HCl(g)和H₂O(g)。③N₂O有强氧化性,不与酸、碱反应,故N₂O将SnCl₂氧化生成SnO₂·xH₂O,自身被还原成N₂,根据得失电子守恒和原子守恒,可知反应的化学方程式为N₂O + SnCl₂ + (x + 1)H₂O = SnO₂·xH₂O↓ + N₂ + 2HCl。
(2) ①根据仪器F的结构特点可知,F的名称为蒸馏烧瓶。②管q将恒压滴液漏斗上下相连,其作用是减小测定气体体积时的误差,并使恒压滴液漏斗中的液体顺利流下。③若G的初始读数为37.20 mL、末读数为1.20 mL,则反应生成N₂的体积为37.20 mL - 1.20 mL = 36.00 mL,实验条件下气体摩尔体积为Vₘ L·mol⁻¹,则N₂物质的量为36.00×10⁻³L÷VₘL·mol⁻¹ = 0.036/Vₘ mol,根据反应原理ClO⁻ + 2N₃⁻ + H₂O = Cl⁻ + 3N₂↑ + 2OH⁻,可知NaN₃物质的量为2/3×0.036/Vₘ mol = 0.024/Vₘ mol,故产品中NaN₃的质量分数为(0.024/Vₘmol×65g·mol⁻¹)÷mg×100% = 156/mVₘ%。
(1) ①f(或g) g(或f) d e ②吸收N₂O中混有的HNO₃、HCl和水蒸气 ③SnCl₂ + N₂O + (x + 1)H₂O = SnO₂·xH₂O↓ + N₂ + 2HCl ④继续通入N₂至三颈烧瓶冷却后,关闭分液漏斗活塞 防止B中液体倒吸入C中,E中液体倒吸入B中
(2) ①蒸馏烧瓶 ②减小测定气体体积时的误差、使恒压滴液漏斗中的液体顺利流下 ③156/mVₘ% 突破点·实验题中钠的化合物的性质探究及其制备 【解析】装置A中稀硝酸和SnCl₂与盐酸的混合液反应制备N₂O,由于HNO₃和HCl具有挥发性且HNO₃具有强氧化性,故所制N₂O中混有HNO₃(g)、HCl(g)和H₂O(g),而NaNH₂易潮解、易被氧化,装置D中碱石灰可吸收N₂O中混有的HNO₃(g)、HCl(g)和H₂O(g),装置C中NaNH₂与N₂O共热发生反应制备NaN₃,装置B中浓硫酸可防止E中H₂O(g)进入装置C中,同时吸收装置C中反应生成的NH₃,最后用足量SnCl₂溶液吸收多余的N₂O。
(1) ①根据上述分析,按气流方向,装置的合理连接顺序为a→f(g)→g(f)→d→e→b→c→h。②由分析可知,装置D中碱石灰用于吸收N₂O中混有的HNO₃(g)、HCl(g)和H₂O(g)。③N₂O有强氧化性,不与酸、碱反应,故N₂O将SnCl₂氧化生成SnO₂·xH₂O,自身被还原成N₂,根据得失电子守恒和原子守恒,可知反应的化学方程式为N₂O + SnCl₂ + (x + 1)H₂O = SnO₂·xH₂O↓ + N₂ + 2HCl。
(2) ①根据仪器F的结构特点可知,F的名称为蒸馏烧瓶。②管q将恒压滴液漏斗上下相连,其作用是减小测定气体体积时的误差,并使恒压滴液漏斗中的液体顺利流下。③若G的初始读数为37.20 mL、末读数为1.20 mL,则反应生成N₂的体积为37.20 mL - 1.20 mL = 36.00 mL,实验条件下气体摩尔体积为Vₘ L·mol⁻¹,则N₂物质的量为36.00×10⁻³L÷VₘL·mol⁻¹ = 0.036/Vₘ mol,根据反应原理ClO⁻ + 2N₃⁻ + H₂O = Cl⁻ + 3N₂↑ + 2OH⁻,可知NaN₃物质的量为2/3×0.036/Vₘ mol = 0.024/Vₘ mol,故产品中NaN₃的质量分数为(0.024/Vₘmol×65g·mol⁻¹)÷mg×100% = 156/mVₘ%。
查看更多完整答案,请扫码查看


