2025年高考必刷题高三化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年高考必刷题高三化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第12页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
1.[河北部分高中2024联考]第ⅤA族元素及其化合物应用广泛。NH₃催化氧化生成NO,NO继续被氧化为NO₂,将NO₂通入水中制取HNO₃。工业上用白磷(P₄)与Ba(OH)₂反应生成PH₃和一种盐,该盐可与H₂SO₄反应制备一元弱酸H₃PO₂。雌黄(As₂S₃)和SnCl₂在盐酸中反应转化为雄黄(As₄S₄)和SnCl₄(沸点为114℃)并放出H₂S气体。下列反应的化学或离子方程式错误的是 ( )
A. NO₂制HNO₃的离子方程式:3NO₂+H₂O = 2H⁺+2NO₃⁻+NO
B. 白磷与Ba(OH)₂溶液反应的化学方程式:2P₄+3Ba(OH)₂+6H₂O = 3Ba(H₂PO₂)₂+2PH₃↑
C. H₃PO₂与足量的NaOH溶液反应的离子方程式:H₃PO₂+3OH⁻ = PO₂³⁻+3H₂O
D. 雌黄制备雄黄的化学方程式:2As₂S₃+2SnCl₂+4HCl = As₄S₄+2SnCl₄+2H₂S↑
A. NO₂制HNO₃的离子方程式:3NO₂+H₂O = 2H⁺+2NO₃⁻+NO
B. 白磷与Ba(OH)₂溶液反应的化学方程式:2P₄+3Ba(OH)₂+6H₂O = 3Ba(H₂PO₂)₂+2PH₃↑
C. H₃PO₂与足量的NaOH溶液反应的离子方程式:H₃PO₂+3OH⁻ = PO₂³⁻+3H₂O
D. 雌黄制备雄黄的化学方程式:2As₂S₃+2SnCl₂+4HCl = As₄S₄+2SnCl₄+2H₂S↑
答案:
C 创新点.信息提取、陌生氧化还原方程式正误判断
[解析]NO与水反应生成硝酸和一氧化氮,离子方程式为3NO+HO=2H++2NO+NO,A正确;由白磷(P4)与
Ba(OH)2反应生成的盐可与HSO反应制备一元弱酸HPO2,可知生成的盐为Ba(HPO2)2,即白磷发生歧化反应生成PH3和
Ba(HPO2)2,化学方程式为2P4+3Ba(OH)2+6H20=
3Ba(H2PO)2+2PH↑,B正确;HPO为一元弱酸,与NaOH反一应生成NaHPO,所以H3PO与足量的NaOH溶液反应的离子方程式为HPO+OH=HPO+HO,C错误;雌黄(AsS3)和SnC12在盐酸中反应转化为雄黄(As4S4)和SnCl((沸点114℃)
并放出HS气体,可知其化学方程式为2AsS3+2SnCl2+4HC1=As4S4+2SnCI4+2H2S↑,D正确。
2.[江苏南京六校联合体2024调研]利用空气催化氧化法除掉电石渣浆(含CaO)上层清液中的S²⁻并制取石膏(CaSO₄·2H₂O)的过程如图。下列说法正确的是 ( )
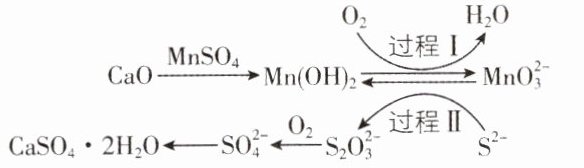
A. CaSO₄·2H₂O属于混合物
B. 过程Ⅰ中氧化剂与氧化产物的物质的量之比为2:1
C. 过程Ⅱ中,反应的离子方程式为4MnO₄²⁻+2S²⁻+10H⁺ = S₂O₃²⁻+4Mn(OH)₂↓+H₂O
D. 将10 L上层清液中的S²⁻(S²⁻浓度为480 mg·L⁻¹)转化为SO₄²⁻,理论上共需要0.3 mol O₂

A. CaSO₄·2H₂O属于混合物
B. 过程Ⅰ中氧化剂与氧化产物的物质的量之比为2:1
C. 过程Ⅱ中,反应的离子方程式为4MnO₄²⁻+2S²⁻+10H⁺ = S₂O₃²⁻+4Mn(OH)₂↓+H₂O
D. 将10 L上层清液中的S²⁻(S²⁻浓度为480 mg·L⁻¹)转化为SO₄²⁻,理论上共需要0.3 mol O₂
答案:
D 创新点信息提取、反应过程分析、氧化还原方程式的配平与计算
[解析]CaSO.2H0为结晶水合物,属于纯净物,A错误;过程识点
1中氧化剂为氧气,得电子生成水,1个氧气分子得4个电子,还原剂为NMn(OH)2,转化为氧化产物MnO,失2个电子,根据得失电子守恒,可知氧化剂与氧化产物的物质的量之比为1:2,B 错误;过程II中,生成物在碱性条件下存在,故反应产生氢氧根离子,反应的离子方程式为4Mn0²+2S²+9H0S20²+4M1n(0H)2↓+100H,C错误;根据得失电子守恒可知,消耗氧气的物质的量n=$\frac{480×10×10}{32}$×$\frac{8}{4}$mol=0.3mol,D正确。
3.[安徽皖江名校2024二模]卤族元素形成的物质种类众多,溴化碘(IBr)的化学性质与卤素相似。已知常温下,几种酸的电离常数:H₂CO₃ $K_{a1}=4.5×10^{-7}$,$K_{a2}=4.7×10^{-11}$;HClO $K_{a}=4.0×10^{-8}$。下列化学反应表示正确的是 ( )
A. IBr与水反应:IBr+H₂O = HI+HBrO
B. 向AlCl₃溶液中加入过量NaOH溶液:Al³⁺+3OH⁻ = Al(OH)₃↓
C. 向AgCl悬浊液中加入Na₂S溶液:2AgCl(s)+S²⁻(aq) = Ag₂S(s)+2Cl⁻(aq)
D. 向NaClO溶液中通入少量CO₂:2ClO⁻+CO₂+H₂O = 2HClO+CO₃²⁻
A. IBr与水反应:IBr+H₂O = HI+HBrO
B. 向AlCl₃溶液中加入过量NaOH溶液:Al³⁺+3OH⁻ = Al(OH)₃↓
C. 向AgCl悬浊液中加入Na₂S溶液:2AgCl(s)+S²⁻(aq) = Ag₂S(s)+2Cl⁻(aq)
D. 向NaClO溶液中通入少量CO₂:2ClO⁻+CO₂+H₂O = 2HClO+CO₃²⁻
答案:
C 考查点.化学或离子方程式的正误判断
[解析]IBr与水反应的化学方程式为1IBr+H20=HBr+HIO,A 错误;向AICI3溶液中加入过量NaOH溶液的离子方程式为
A13++4OH=[AI(OH)4]−,B错误;向AgC1悬浊液中加入
Na2S溶液时发生沉淀转化2AgCl(s)+S²(aq)−Ag2S(s)+2CI−(aq),C正确:酸性强弱关系为HCO>HCIO>HCO,故向NaC10溶液中通入少量CO2,离子方程式为C10−+CO2+H20=
HCIO+HCO,D错误。
4.[湖南九校2024二模]硫代硫酸钠的制备和应用的相关流程如图所示,下列相关离子方程式的书写正确的是 ( )
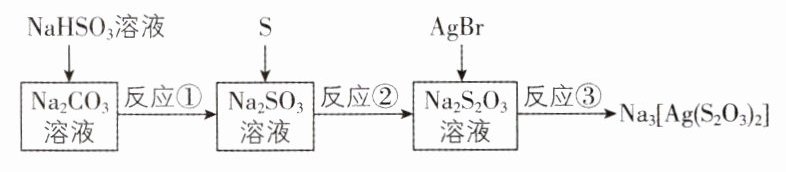
已知:$K_{a1}(H_{2}SO_{3})>K_{a1}(H_{2}CO_{3})>K_{a2}(H_{2}SO_{3})>K_{a2}(H_{2}CO_{3})$。
A. 反应③:Ag⁺+2S₂O₃²⁻ = [Ag(S₂O₃)₂]³⁻
B. 向Na₂S₂O₃溶液中加入稀硫酸:3S₂O₃²⁻+2H⁺ = 4S↓+2SO₄²⁻+H₂O
C. 用Na₂S₂O₃溶液测定碘单质的含量时生成Na₂S₄O₆,其离子方程式为I₂+2S₂O₃²⁻ = 2I⁻+S₄O₆²⁻
D. 反应①:CO₃²⁻+2HSO₃⁻ = 2SO₃²⁻+CO₂↑+H₂O

已知:$K_{a1}(H_{2}SO_{3})>K_{a1}(H_{2}CO_{3})>K_{a2}(H_{2}SO_{3})>K_{a2}(H_{2}CO_{3})$。
A. 反应③:Ag⁺+2S₂O₃²⁻ = [Ag(S₂O₃)₂]³⁻
B. 向Na₂S₂O₃溶液中加入稀硫酸:3S₂O₃²⁻+2H⁺ = 4S↓+2SO₄²⁻+H₂O
C. 用Na₂S₂O₃溶液测定碘单质的含量时生成Na₂S₄O₆,其离子方程式为I₂+2S₂O₃²⁻ = 2I⁻+S₄O₆²⁻
D. 反应①:CO₃²⁻+2HSO₃⁻ = 2SO₃²⁻+CO₂↑+H₂O
答案:
C 考查点.离子方程式的正误判断
[解析]反应③为硫代硫酸钠溶液与溴化银固体反应生成二硫代硫酸根合银酸钠和溴化钠,AgBr在离子方程式中不可拆,离子方 −程式为AgBr+2S20;−=[Ag(S2O)2]3−+Br,故A错误;硫代硫酸钠溶液与稀硫酸反应生成硫酸钠、二氧化硫、硫单质和水,离子方程式为S20+2H+=S↓+SO2↑+H0,故B错误;硫代硫酸钠溶液与碘反应生成连二硫酸钠,离子方程式为12+2S20;2I+S4O,故C正确;反应①为碳酸钠溶液与亚硫酸氢钠溶液反应,由于K(HCO)>K(HSO)>K(HCO),可知该反应生成亚硫酸钠和碳酸氢钠,离子方程式为CO+HSOSO²+HCO,故D错误。
5.[山西重点高中2024联考]科研小组用氧化—沉淀法从废电池浸出液中去除铁:用MnO₂氧化废电池浸出液中的Fe²⁺(酸性条件下,MnO₂被还原为Mn²⁺),再加适量Na₂CO₃溶液调pH,使Fe³⁺转化为Fe(OH)₃沉淀。研究发现pH对Fe²⁺氧化率和铁去除率的影响分别如图甲和图乙所示。
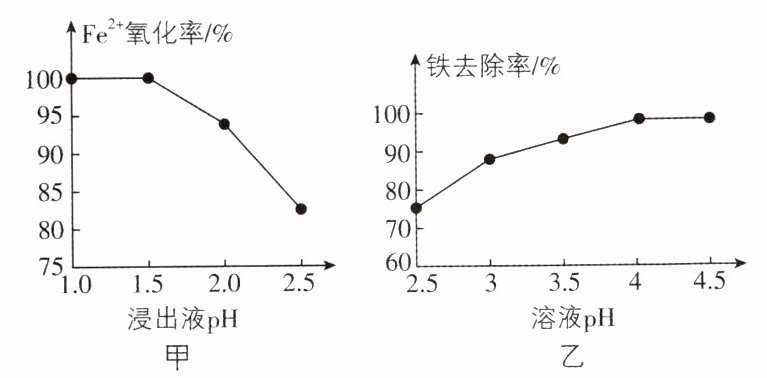
下列说法错误的是 ( )
A. 由图甲可推断MnO₂的氧化性随浸出液pH的增大而减弱
B. 若起始浸出液pH = 1,MnO₂与Fe²⁺反应一段时间后,浸出液pH会减小
C. Fe³⁺转变为沉淀的离子方程式为2Fe³⁺+3CO₃²⁻+3H₂O = 2Fe(OH)₃↓+3CO₂↑
D. 推测若用NaHCO₃溶液调pH也可以使Fe³⁺转化为Fe(OH)₃沉淀

下列说法错误的是 ( )
A. 由图甲可推断MnO₂的氧化性随浸出液pH的增大而减弱
B. 若起始浸出液pH = 1,MnO₂与Fe²⁺反应一段时间后,浸出液pH会减小
C. Fe³⁺转变为沉淀的离子方程式为2Fe³⁺+3CO₃²⁻+3H₂O = 2Fe(OH)₃↓+3CO₂↑
D. 推测若用NaHCO₃溶液调pH也可以使Fe³⁺转化为Fe(OH)₃沉淀
答案:
B 创新点.图像分析、陌生氧化还原方程式正误判断
[解析]由图甲可知,Fe2+氧化率随浸出液pH的增大而减小,故可推断MnO2的氧化性随浸出液pH的增大而减弱,A正确;酸性溶液中,MnO2与Fe²反应的离子方程式为Mn02+2Fe²+4HMn²++2Fe+2H20,反应消耗H'生成H0,反应一段时间后,浸出液pH会增大,B错误;加适量NaCO溶液,Fe转变为沉淀的离子方程式为2Fe+3CO;+3H0=2Fe(OH)3↓+3CO2↑,C 正确;用NaHCO溶液调pH也可以使Fe3+转化为Fe(OH)3沉淀,反应的离子方程式为Fe3++3HCO=Fe(OH)3↓+3CO2↑,
D正确。
查看更多完整答案,请扫码查看


