2025年学霸高考黑题化学人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年学霸高考黑题化学人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第99页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
经典真题 1(化学反应速率影响因素类)
(2025·甘肃,17 题节选)乙炔加氢是除去乙烯中少量乙炔杂质,得到高纯度乙烯的重要方法。该过程包括以下两个主要反应:
反应 1:$C_{2}H_{2}(g)+H_{2}(g)\xlongequal{}C_{2}H_{4}(g)$ $\Delta H_{1}=-175kJ· mol^{-1}(25^{\circ}C,101kPa)$
反应 2:$C_{2}H_{2}(g)+2H_{2}(g)\xlongequal{}C_{2}H_{6}(g)$ $\Delta H_{2}=-312kJ· mol^{-1}(25^{\circ}C,101kPa)$
(1)一定条件下,使用某含 Co 催化剂,在不同温度下测得乙炔转化率和产物选择性(指定产物的物质的量/转化的乙炔的物质的量)如图所示(反应均未达平衡)。
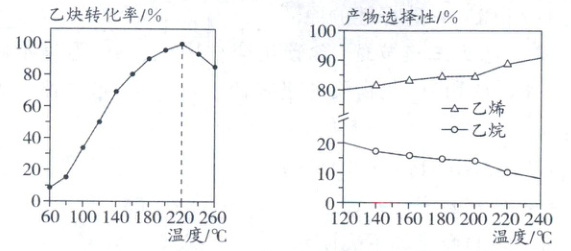
①在 $60\sim220^{\circ}C$ 范围内,乙炔转化率随温度升高而增大的原因为
②在 $120\sim240^{\circ}C$ 范围内,反应 1 和反应 2 乙炔的转化速率大小关系为 $v_{1}$
(2)对于反应 1,反应速率 $v(C_{2}H_{2})$ 与 $H_{2}$ 浓度 $c(H_{2})$ 的关系可用方程式 $v(C_{2}H_{2})=k[c(H_{2})]^{a}$ 表示 ($k$ 为常数)。$145^{\circ}C$ 时,保持其他条件不变,测定了不同浓度时的反应速率(如下表)。当 $v(C_{2}H_{2})=1.012×10^{-4}mol· L^{-1}· s^{-1}$ 时,$c(H_{2})=$

(2025·甘肃,17 题节选)乙炔加氢是除去乙烯中少量乙炔杂质,得到高纯度乙烯的重要方法。该过程包括以下两个主要反应:
反应 1:$C_{2}H_{2}(g)+H_{2}(g)\xlongequal{}C_{2}H_{4}(g)$ $\Delta H_{1}=-175kJ· mol^{-1}(25^{\circ}C,101kPa)$
反应 2:$C_{2}H_{2}(g)+2H_{2}(g)\xlongequal{}C_{2}H_{6}(g)$ $\Delta H_{2}=-312kJ· mol^{-1}(25^{\circ}C,101kPa)$
(1)一定条件下,使用某含 Co 催化剂,在不同温度下测得乙炔转化率和产物选择性(指定产物的物质的量/转化的乙炔的物质的量)如图所示(反应均未达平衡)。

①在 $60\sim220^{\circ}C$ 范围内,乙炔转化率随温度升高而增大的原因为
温度升高,反应速率加快或温度升高,催化剂活性增强
(任写一条),当温度由 $220^{\circ}C$ 升高至 $260^{\circ}C$,乙炔转化率减小的原因可能为 催化剂在该温度范围内失活
。②在 $120\sim240^{\circ}C$ 范围内,反应 1 和反应 2 乙炔的转化速率大小关系为 $v_{1}$
>
$v_{2}$ (填“$>$”“$<$”或“$=$”),理由为 乙烯的选择性大于乙烷,说明反应1乙炔的转化速率大于反应2乙炔的转化速率
。(2)对于反应 1,反应速率 $v(C_{2}H_{2})$ 与 $H_{2}$ 浓度 $c(H_{2})$ 的关系可用方程式 $v(C_{2}H_{2})=k[c(H_{2})]^{a}$ 表示 ($k$ 为常数)。$145^{\circ}C$ 时,保持其他条件不变,测定了不同浓度时的反应速率(如下表)。当 $v(C_{2}H_{2})=1.012×10^{-4}mol· L^{-1}· s^{-1}$ 时,$c(H_{2})=$
9.2×10⁻³
$mol· L^{-1}$。
答案:
经典真题1
(1)①温度升高,反应速率加快或温度升高,催化剂活性增强;催化剂在该温度范围内失活 ②> 乙烯的选择性大于乙烷,说明反应1乙炔的转化速率大于反应2乙炔的转化速率
(2)9.2×10⁻³
解题思路
分析在反应未达到平衡情况下的转化率随温度变化的图像时,主要考虑转化率受反应速率的影响,分析时关注反应速率的影响因素(浓度、温度、压强、催化剂等)。
解析:
(1)①反应未达到平衡状态,温度升高,反应速率加快,乙炔的转化率增大或温度升高,催化剂活性增强,乙炔的转化率增大;220~260℃,乙炔的转化率下降,反应未达平衡状态,说明不是由于平衡移动造成的,可能原因是催化剂在该温度范围内失活;②由图像可知,乙烯的选择性大于乙烷,说明反应1乙炔的转化速率大于反应2乙炔的转化速率,即v₁>v₂。
(2)将数据代入方程$\begin{cases} ①5.06×10^{-5}=k×(4.6×10^{-3})^{\alpha} \\ ②2.158×10^{-4}=k×(1.38×10^{-2})^{\alpha} \end{cases}$,②÷①得到$\alpha = 1$,则$k = 1.1×10^{-2}$,$v(C₂H₂)=1.012×10^{-4}mol·L^{-1}·s^{-1}$时,$1.012×10^{-4}=1.1×10^{-2}×c(H₂)$,$c(H₂)=9.2×10^{-3}mol·L^{-1}$。
(1)①温度升高,反应速率加快或温度升高,催化剂活性增强;催化剂在该温度范围内失活 ②> 乙烯的选择性大于乙烷,说明反应1乙炔的转化速率大于反应2乙炔的转化速率
(2)9.2×10⁻³
解题思路
分析在反应未达到平衡情况下的转化率随温度变化的图像时,主要考虑转化率受反应速率的影响,分析时关注反应速率的影响因素(浓度、温度、压强、催化剂等)。
解析:
(1)①反应未达到平衡状态,温度升高,反应速率加快,乙炔的转化率增大或温度升高,催化剂活性增强,乙炔的转化率增大;220~260℃,乙炔的转化率下降,反应未达平衡状态,说明不是由于平衡移动造成的,可能原因是催化剂在该温度范围内失活;②由图像可知,乙烯的选择性大于乙烷,说明反应1乙炔的转化速率大于反应2乙炔的转化速率,即v₁>v₂。
(2)将数据代入方程$\begin{cases} ①5.06×10^{-5}=k×(4.6×10^{-3})^{\alpha} \\ ②2.158×10^{-4}=k×(1.38×10^{-2})^{\alpha} \end{cases}$,②÷①得到$\alpha = 1$,则$k = 1.1×10^{-2}$,$v(C₂H₂)=1.012×10^{-4}mol·L^{-1}·s^{-1}$时,$1.012×10^{-4}=1.1×10^{-2}×c(H₂)$,$c(H₂)=9.2×10^{-3}mol·L^{-1}$。
经典真题 2(计算反应速率类)
(2024·全国甲,28 题节选)甲烷转化为多碳化合物具有重要意义。一种将甲烷溴化再偶联为丙烯$(C_{3}H_{6})$的研究获得的部分数据如下。回答下列问题:
少量 $I_{2}$ 可提高生成 $CH_{3}Br$ 的选择性。$500^{\circ}C$ 时,分别在有 $I_{2}$ 和无 $I_{2}$ 的条件下,将 $8mmolCH_{4}$ 和 $8mmolBr_{2}$ 通入密闭容器,溴代甲烷的物质的量$(n)$随时间$(t)$的变化关系如图。
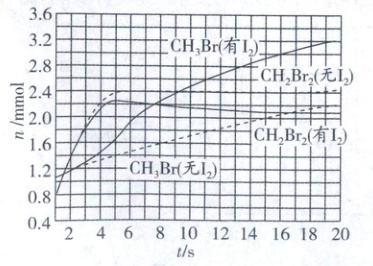
(1)在 $11\sim19s$ 之间,有 $I_{2}$ 和无 $I_{2}$ 时 $CH_{3}Br$ 的生成速率之比 $\frac{v(有I_{2})}{v(无I_{2})}=$
(2)从图中找出 $I_{2}$ 提高了 $CH_{3}Br$ 选择性的证据:
(3)研究表明,$I_{2}$ 参与反应的可能机理如下:
①$I_{2}(g)\xlongequal{}· I(g)+· I(g)$
②$· I(g)+CH_{2}Br_{2}(g)\xlongequal{}IBr(g)+· CH_{2}Br(g)$
③$· CH_{2}Br(g)+HBr(g)\xlongequal{}CH_{3}Br(g)+· Br(g)$
④$· Br(g)+CH_{4}(g)\xlongequal{}HBr(g)+· CH_{3}(g)$
⑤$· CH_{3}(g)+IBr(g)\xlongequal{}CH_{3}Br(g)+· I(g)$
⑥$· I(g)+· I(g)\xlongequal{}I_{2}(g)$
根据上述机理,分析 $I_{2}$ 提高 $CH_{3}Br$ 选择性的原因:
(2024·全国甲,28 题节选)甲烷转化为多碳化合物具有重要意义。一种将甲烷溴化再偶联为丙烯$(C_{3}H_{6})$的研究获得的部分数据如下。回答下列问题:
少量 $I_{2}$ 可提高生成 $CH_{3}Br$ 的选择性。$500^{\circ}C$ 时,分别在有 $I_{2}$ 和无 $I_{2}$ 的条件下,将 $8mmolCH_{4}$ 和 $8mmolBr_{2}$ 通入密闭容器,溴代甲烷的物质的量$(n)$随时间$(t)$的变化关系如图。

(1)在 $11\sim19s$ 之间,有 $I_{2}$ 和无 $I_{2}$ 时 $CH_{3}Br$ 的生成速率之比 $\frac{v(有I_{2})}{v(无I_{2})}=$
\frac{3}{2}(或3:2)
$$。(2)从图中找出 $I_{2}$ 提高了 $CH_{3}Br$ 选择性的证据:
5 s以后有I₂催化的CH₂Br₂的含量逐渐降低,有I₂催化的CH₃Br的含量陡然上升
。(3)研究表明,$I_{2}$ 参与反应的可能机理如下:
①$I_{2}(g)\xlongequal{}· I(g)+· I(g)$
②$· I(g)+CH_{2}Br_{2}(g)\xlongequal{}IBr(g)+· CH_{2}Br(g)$
③$· CH_{2}Br(g)+HBr(g)\xlongequal{}CH_{3}Br(g)+· Br(g)$
④$· Br(g)+CH_{4}(g)\xlongequal{}HBr(g)+· CH_{3}(g)$
⑤$· CH_{3}(g)+IBr(g)\xlongequal{}CH_{3}Br(g)+· I(g)$
⑥$· I(g)+· I(g)\xlongequal{}I_{2}(g)$
根据上述机理,分析 $I_{2}$ 提高 $CH_{3}Br$ 选择性的原因:
I₂的投入消耗了部分CH₂Br₂,使得消耗的CH₂Br₂发生反应生成了CH₃Br
。
答案:
经典真题2
(1)$\frac{3}{2}$(或3:2)
(2)5 s以后有I₂催化的CH₂Br₂的含量逐渐降低,有I₂催化的CH₃Br的含量陡然上升
(3)I₂的投入消耗了部分CH₂Br₂,使得消耗的CH₂Br₂发生反应生成了CH₃Br
解题思路
根据一段时间内物质的含量变化计算速率并计算速率比,并根据图示信息和反应机理判断合适的原因。
解析:
(1)11~19 s时,有I₂时CH₃Br的生成速率$v=\frac{3.2 - 2.4}{8}\frac{V}{V}\frac{0.075}{V}= \frac{0.075}{V}mmol·(L·s)^{-1}$,无I₂时CH₃Br的生成速率$v=\frac{2.2 - 1.8}{8}\frac{V}{V}\frac{0.05}{V}=\frac{0.05}{V}mmol·(L·s)^{-1}$。生成速率之比$\frac{v(有I₂)}{v(无I₂)}=\frac{\frac{0.075}{V}}{\frac{0.05}{V}}=\frac{3}{2}$。
(2)从图中可以看出,大约5 s以后有I₂催化的CH₂Br₂的含量逐渐降低,有I₂催化的CH₃Br的含量陡然上升,因此,可以利用此变化判断I₂提高了CH₃Br的选择性。
(3)根据反应机理,I₂的投入消耗了部分CH₂Br₂,同时也消耗了部分HBr,使得消耗的CH₂Br₂发生反应生成了CH₃Br,提高了CH₃Br的选择性。
(1)$\frac{3}{2}$(或3:2)
(2)5 s以后有I₂催化的CH₂Br₂的含量逐渐降低,有I₂催化的CH₃Br的含量陡然上升
(3)I₂的投入消耗了部分CH₂Br₂,使得消耗的CH₂Br₂发生反应生成了CH₃Br
解题思路
根据一段时间内物质的含量变化计算速率并计算速率比,并根据图示信息和反应机理判断合适的原因。
解析:
(1)11~19 s时,有I₂时CH₃Br的生成速率$v=\frac{3.2 - 2.4}{8}\frac{V}{V}\frac{0.075}{V}= \frac{0.075}{V}mmol·(L·s)^{-1}$,无I₂时CH₃Br的生成速率$v=\frac{2.2 - 1.8}{8}\frac{V}{V}\frac{0.05}{V}=\frac{0.05}{V}mmol·(L·s)^{-1}$。生成速率之比$\frac{v(有I₂)}{v(无I₂)}=\frac{\frac{0.075}{V}}{\frac{0.05}{V}}=\frac{3}{2}$。
(2)从图中可以看出,大约5 s以后有I₂催化的CH₂Br₂的含量逐渐降低,有I₂催化的CH₃Br的含量陡然上升,因此,可以利用此变化判断I₂提高了CH₃Br的选择性。
(3)根据反应机理,I₂的投入消耗了部分CH₂Br₂,同时也消耗了部分HBr,使得消耗的CH₂Br₂发生反应生成了CH₃Br,提高了CH₃Br的选择性。
查看更多完整答案,请扫码查看


