2025年学霸高考黑题化学人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年学霸高考黑题化学人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第74页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
经典真题 分离提纯类
(2025·安徽,15,14分)某含锶(Sr)废渣主要含有SrSO₄、SiO₂、CaCO₃、SrCO₃和MgCO₃等,一种提取该废渣中锶的流程如下图所示。

已知25℃时,Kₛₚ(SrSO₄)=10⁻⁶.⁴⁶,Kₛₚ(BaSO₄)=10⁻⁹.⁹⁷。
回答下列问题:
(1)锶位于元素周期表第五周期第ⅡA族。基态原子价电子排布式为
(2)“浸出液”中主要的金属离子有Sr²⁺、
(3)“盐浸”中SrSO₄转化反应的离子方程式为
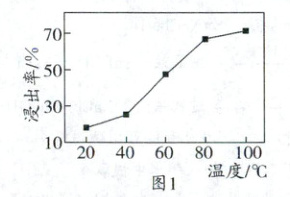
(4)其他条件相同时,盐浸2h,浸出温度对锶浸出率的影响如图1所示。随温度升高锶浸出率增大的原因是
(5)“浸出渣2”中主要含有SrSO₄、
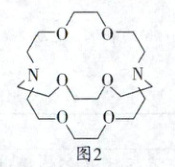
(6)将窝穴体a(结构如图2所示)与K⁺形成的超分子加入“浸出液”中,能提取其中的Sr²⁺,原因是
(7)由SrCl₂·6H₂O制备无水SrCl₂的最优方法是
a.加热脱水
b.在HCl气流中加热
c.常温加压
d.加热加压
(2025·安徽,15,14分)某含锶(Sr)废渣主要含有SrSO₄、SiO₂、CaCO₃、SrCO₃和MgCO₃等,一种提取该废渣中锶的流程如下图所示。

已知25℃时,Kₛₚ(SrSO₄)=10⁻⁶.⁴⁶,Kₛₚ(BaSO₄)=10⁻⁹.⁹⁷。
回答下列问题:
(1)锶位于元素周期表第五周期第ⅡA族。基态原子价电子排布式为
5s²
。(2)“浸出液”中主要的金属离子有Sr²⁺、
Ca²⁺、Mg²⁺
(填离子符号)。(3)“盐浸”中SrSO₄转化反应的离子方程式为
SrSO₄(s)+Ba²⁺(aq)⇌BaSO₄(s)+Sr²⁺(aq)
;25℃时,向0.01mol SrSO₄粉末中加入100mL 0.11mol·L⁻¹ BaCl₂溶液,充分反应后,理论上溶液中c(Sr²⁺)·c(SO₄²⁻)=10⁻⁸.⁹⁷
(mol·L⁻¹)²(忽略溶液体积的变化)。(4)其他条件相同时,盐浸2h,浸出温度对锶浸出率的影响如图1所示。随温度升高锶浸出率增大的原因是
升高温度,Ba²⁺与SrSO₄有效碰撞次数增加,反应速率加快,所以锶浸出率增大
。(5)“浸出渣2”中主要含有SrSO₄、
BaSO₄、SiO₂
(填化学式)。(6)将窝穴体a(结构如图2所示)与K⁺形成的超分子加入“浸出液”中,能提取其中的Sr²⁺,原因是
窝穴体a的空腔与Sr²⁺更匹配,可通过分子间相互作用形成超分子,且Sr²⁺具有更多的空轨道,能够与更多的N、O形成配位键,形成超分子后,结构更稳定
。(7)由SrCl₂·6H₂O制备无水SrCl₂的最优方法是
a
(填字母)。a.加热脱水
b.在HCl气流中加热
c.常温加压
d.加热加压


答案:
经典真题
(1)5s²
(2)Ca²⁺、Mg²⁺
(3)SrSO₄(s)+Ba²⁺(aq)⇌BaSO₄(s)+Sr²⁺(aq) 10⁻⁸.⁹⁷
(4)升高温度,Ba²⁺与SrSO₄有效碰撞次数增加,反应速率加快,所以锶浸出率增大
(5)BaSO₄、SiO₂
(6)窝穴体a的空腔与Sr²⁺更匹配,可通过分子间相互作用形成超分子,且Sr²⁺具有更多的空轨道,能够与更多的N、O形成配位键,形成超分子后,结构更稳定
(7)a
解题思路

解析:
(1)锶位于元素周期表第五周期第ⅡA族,基态原子价电子排布式为5s²。
(2)由分析可知,碳酸盐均能溶于盐酸,“浸出液”中主要的金属离子有Sr²⁺、Ca²⁺、Mg²⁺。
(3)由分析可知,“盐浸”中发生沉淀的转化,离子方程式为SrSO₄(s)+Ba²⁺(aq)⇌BaSO₄(s)+Sr²⁺(aq);该反应的平衡常数$K=\frac{c(Sr^{2 + })}{c(Ba^{2 + })}=\frac{c(Sr^{2 + })· c(SO_{4}^{2 - })}{c(Ba^{2 + })· c(SO_{4}^{2 - })}=\frac{K_{sp}(SrSO_{4})}{K_{sp}(BaSO_{4})}=\frac{10^{-6.46}}{10^{-9.97}} = 10^{3.51}$,平衡常数很大,近似认为SrSO₄完全转化,溶液中剩余$n(Ba^{2 + })=1×10^{-3}mol$,则$c(SO_{4}^{2 - })=\frac{K_{sp}(BaSO_{4})}{c(Ba^{2 + })} = 10^{-7.97}mol· L^{-1}$,列三段式:
$\begin{matrix} & SrSO_{4}(s)+ & Ba^{2 + }(aq)\rightleftharpoons & BaSO_{4}(s)+ & Sr^{2 + }(aq) \\ 初始/mol & 0.01 & 0.011 & 0 & 0 \\ 变化/mol & 0.01 & 0.01 & 0.01 & 0.01 \\ 平衡/mol & 0 & 0.001 & 0.01 & 0.01 \end{matrix}$
理论上溶液中$c(Sr^{2 + })· c(SO_{4}^{2 - })=10^{-7.97}mol· L^{-1}×0.1mol· L^{-1}=10^{-8.97}(mol· L^{-1})^{2}$。
(4)随温度升高锶浸出率增大,原因是升高温度,Ba²⁺与SrSO₄有效碰撞次数增加,反应速率加快,所以锶浸出率增大。
(5)“盐浸”时发生沉淀的转化,生成了BaSO₄、SiO₂不参与反应,故“浸出渣2”中主要含有SrSO₄、BaSO₄、SiO₂。
(6)窝穴体a与K⁺形成的超分子加入“浸出液”中,能提取其中的Sr²⁺,原因是窝穴体a的空腔与Sr²⁺更匹配,可通过分子间相互作用形成超分子,且Sr²⁺具有更多的空轨道,能够与更多的N、O形成配位键,形成超分子后,结构更稳定。
(7)Ca(OH)₂为强碱,则Sr(OH)₂也是强碱,Sr²⁺不水解,排除b,由平衡移动原理可知SrCl₂·6H₂O制备无水SrCl₂的方法加压不利于脱水,排除c、d,故选a。
经典真题
(1)5s²
(2)Ca²⁺、Mg²⁺
(3)SrSO₄(s)+Ba²⁺(aq)⇌BaSO₄(s)+Sr²⁺(aq) 10⁻⁸.⁹⁷
(4)升高温度,Ba²⁺与SrSO₄有效碰撞次数增加,反应速率加快,所以锶浸出率增大
(5)BaSO₄、SiO₂
(6)窝穴体a的空腔与Sr²⁺更匹配,可通过分子间相互作用形成超分子,且Sr²⁺具有更多的空轨道,能够与更多的N、O形成配位键,形成超分子后,结构更稳定
(7)a
解题思路

解析:
(1)锶位于元素周期表第五周期第ⅡA族,基态原子价电子排布式为5s²。
(2)由分析可知,碳酸盐均能溶于盐酸,“浸出液”中主要的金属离子有Sr²⁺、Ca²⁺、Mg²⁺。
(3)由分析可知,“盐浸”中发生沉淀的转化,离子方程式为SrSO₄(s)+Ba²⁺(aq)⇌BaSO₄(s)+Sr²⁺(aq);该反应的平衡常数$K=\frac{c(Sr^{2 + })}{c(Ba^{2 + })}=\frac{c(Sr^{2 + })· c(SO_{4}^{2 - })}{c(Ba^{2 + })· c(SO_{4}^{2 - })}=\frac{K_{sp}(SrSO_{4})}{K_{sp}(BaSO_{4})}=\frac{10^{-6.46}}{10^{-9.97}} = 10^{3.51}$,平衡常数很大,近似认为SrSO₄完全转化,溶液中剩余$n(Ba^{2 + })=1×10^{-3}mol$,则$c(SO_{4}^{2 - })=\frac{K_{sp}(BaSO_{4})}{c(Ba^{2 + })} = 10^{-7.97}mol· L^{-1}$,列三段式:
$\begin{matrix} & SrSO_{4}(s)+ & Ba^{2 + }(aq)\rightleftharpoons & BaSO_{4}(s)+ & Sr^{2 + }(aq) \\ 初始/mol & 0.01 & 0.011 & 0 & 0 \\ 变化/mol & 0.01 & 0.01 & 0.01 & 0.01 \\ 平衡/mol & 0 & 0.001 & 0.01 & 0.01 \end{matrix}$
理论上溶液中$c(Sr^{2 + })· c(SO_{4}^{2 - })=10^{-7.97}mol· L^{-1}×0.1mol· L^{-1}=10^{-8.97}(mol· L^{-1})^{2}$。
(4)随温度升高锶浸出率增大,原因是升高温度,Ba²⁺与SrSO₄有效碰撞次数增加,反应速率加快,所以锶浸出率增大。
(5)“盐浸”时发生沉淀的转化,生成了BaSO₄、SiO₂不参与反应,故“浸出渣2”中主要含有SrSO₄、BaSO₄、SiO₂。
(6)窝穴体a与K⁺形成的超分子加入“浸出液”中,能提取其中的Sr²⁺,原因是窝穴体a的空腔与Sr²⁺更匹配,可通过分子间相互作用形成超分子,且Sr²⁺具有更多的空轨道,能够与更多的N、O形成配位键,形成超分子后,结构更稳定。
(7)Ca(OH)₂为强碱,则Sr(OH)₂也是强碱,Sr²⁺不水解,排除b,由平衡移动原理可知SrCl₂·6H₂O制备无水SrCl₂的方法加压不利于脱水,排除c、d,故选a。
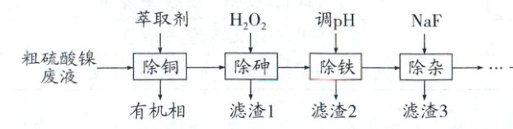
(2025·贵州贵阳二模)铜冶炼过程中,产生的粗硫酸镍废液中含有Cu²⁺、Fe²⁺、Ca²⁺、Mg²⁺、H₃AsO₃等杂质微粒,工业生产以此为原料,精制硫酸镍,主要流程如下:
已知:H₃AsO₃是一种三元弱酸。常温下,Kₛₚ[Fe(OH)₃]=3.0×10⁻³⁹;Kₛₚ[Ni(OH)₂]=5.0×10⁻¹⁶。
回答下列问题:
(1)基态Ni²⁺的价层电子轨道表示式为
(2)“除砷”步骤中,温度不能过高的原因是
(3)常温下,调pH的目的是进一步去除Fe³⁺,使c(Fe³⁺)≤3.0×10⁻¹²mol·L⁻¹。若溶液中c(Ni²⁺)=0.05mol·L⁻¹,则需控制pH的范围是
(4)滤渣3的主要成分是
(5)资料显示,硫酸镍结晶水合物的形态与温度有如下关系。

①从NiSO₄溶液获得稳定的NiSO₄·6H₂O晶体的操作依次是蒸发浓缩、
②NiSO₄·6H₂O晶体煅烧时剩余固体质量与温度变化曲线如图1所示,则200℃时所得到产物的化学式为
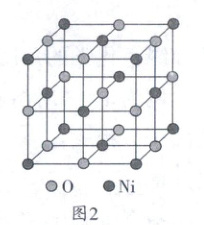
(6)氧化镍晶胞如图2所示,已知晶胞参数为a pm,设Nₐ为阿伏加德罗常数的值,则氧化镍晶体的摩尔体积Vₘ=


已知:H₃AsO₃是一种三元弱酸。常温下,Kₛₚ[Fe(OH)₃]=3.0×10⁻³⁹;Kₛₚ[Ni(OH)₂]=5.0×10⁻¹⁶。
回答下列问题:
(1)基态Ni²⁺的价层电子轨道表示式为
$\uparrow\downarrow\uparrow\downarrow\uparrow\downarrow\uparrow\downarrow\uparrow\uparrow$
。(2)“除砷”步骤中,温度不能过高的原因是
防止H₂O₂受热分解
,滤渣1的主要成分是FeAsO₄。写出该步骤生成FeAsO₄的离子方程式$2H_{3}AsO_{3}+2Fe^{2 + }+3H_{2}O_{2}\xlongequal{}2FeAsO_{4}\downarrow+4H_{2}O + 4H^{+}$
。(3)常温下,调pH的目的是进一步去除Fe³⁺,使c(Fe³⁺)≤3.0×10⁻¹²mol·L⁻¹。若溶液中c(Ni²⁺)=0.05mol·L⁻¹,则需控制pH的范围是
5≤pH<7
。(4)滤渣3的主要成分是
CaF₂、MgF₂
。(5)资料显示,硫酸镍结晶水合物的形态与温度有如下关系。

①从NiSO₄溶液获得稳定的NiSO₄·6H₂O晶体的操作依次是蒸发浓缩、
冷却至30~54℃结晶
、过滤、洗涤、干燥。②NiSO₄·6H₂O晶体煅烧时剩余固体质量与温度变化曲线如图1所示,则200℃时所得到产物的化学式为
NiSO₄·H₂O
。(6)氧化镍晶胞如图2所示,已知晶胞参数为a pm,设Nₐ为阿伏加德罗常数的值,则氧化镍晶体的摩尔体积Vₘ=
$\frac{a^{3}×10^{-36}N_{A}}{4}$
m³·mol⁻¹。

答案:
巩固训练1
(1)$\uparrow\downarrow\uparrow\downarrow\uparrow\downarrow\uparrow\downarrow\uparrow\uparrow$
(2)防止H₂O₂受热分解 $2H_{3}AsO_{3}+2Fe^{2 + }+3H_{2}O_{2}\xlongequal{}2FeAsO_{4}\downarrow+4H_{2}O + 4H^{+}$
(3)5≤pH<7
(4)CaF₂、MgF₂
(5)①冷却至30~54℃结晶②NiSO₄·H₂O
(6)$\frac{a^{3}×10^{-36}N_{A}}{4}$
解题思路
粗硫酸镍废液中加入有机萃取剂分离出含铜离子的有机相,水相中加入过氧化氢氧化亚铁离子为铁离子,氧化三价砷为五价砷,铁离子使得砷转化为FeAsO₄沉淀;滤液调节pH使得剩余铁离子转化为氢氧化铁沉淀得到滤渣2,滤液加入NaF使得钙离子、镁离子转化为氟化钙和氟化镁沉淀得到滤渣3,滤液处理得到NiSO₄·6H₂O。
解析:
(1)镍原子失去2个电子形成Ni²⁺,基态Ni²⁺的价层电子轨道表示式为 。
。
(2)过氧化氢不稳定,受热容易分解,温度不能过高是防止H₂O₂受热分解;加入过氧化氢氧化亚铁离子为铁离子,氧化三价砷为五价砷,铁离子使得五价砷转化为FeAsO₄沉淀,反应为$2H_{3}AsO_{3}+2Fe^{2 + }+3H_{2}O_{2}\xlongequal{}2FeAsO_{4}\downarrow+4H_{2}O + 4H^{+}$。
(3)调pH的目的是进一步去除Fe³⁺,使$c(Fe^{3 + })\leq3.0×10^{-12}mol· L^{-1}$,则$c(OH^{-})=\sqrt[3]{\frac{K_{sp}[Fe(OH)_{3}]}{c(Fe^{3 + })}}=\sqrt[3]{\frac{3.0×10^{-39}}{3.0×10^{-12}}}mol· L^{-1}=1.0×10^{-9}mol· L^{-1}$,pOH = 9,pH = 5;若溶液中$c(Ni^{2 + })=0.05mol· L^{-1}$,则其沉淀所需$c(OH^{-})=\sqrt{\frac{K_{sp}[Ni(OH)_{2}]}{c(Ni^{2 + })}}=\sqrt{\frac{5.0×10^{-16}}{0.05}}mol· L^{-1}=1.0×10^{-7}mol· L^{-1}$,pOH = 7,pH = 7,故需控制pH的范围是5≤pH<7。
(4)由分析,滤渣3的主要成分是CaF₂、MgF₂。
(5)①由表,30~54℃结晶得到NiSO₄·6H₂O,故从NiSO₄溶液获得稳定的NiSO₄·6H₂O晶体的操作依次是蒸发浓缩、冷却至30~54℃结晶、过滤、洗涤、干燥。②26.3gNiSO₄·6H₂O晶体的物质的量为26.3g÷263g·mol⁻¹ = 0.1mol,含有0.6molH₂O,煅烧时剩余固体质量与温度变化曲线如题图所示,200℃时物质减少0.5molH₂O,则得到产物的化学式为NiSO₄·H₂O。
(6)据“均摊法”,晶胞中含$8×\frac{1}{8}+6×\frac{1}{2}=4$个Ni、$12×\frac{1}{4}+1 = 4$个O,则氧化镍晶体的摩尔体积$V_{m}=\frac{a^{3}×10^{-36}}{4}× N_{A}m^{3}· mol^{-1}=\frac{a^{3}×10^{-36}N_{A}}{4}m^{3}· mol^{-1}$。
巩固训练1
(1)$\uparrow\downarrow\uparrow\downarrow\uparrow\downarrow\uparrow\downarrow\uparrow\uparrow$
(2)防止H₂O₂受热分解 $2H_{3}AsO_{3}+2Fe^{2 + }+3H_{2}O_{2}\xlongequal{}2FeAsO_{4}\downarrow+4H_{2}O + 4H^{+}$
(3)5≤pH<7
(4)CaF₂、MgF₂
(5)①冷却至30~54℃结晶②NiSO₄·H₂O
(6)$\frac{a^{3}×10^{-36}N_{A}}{4}$
解题思路
粗硫酸镍废液中加入有机萃取剂分离出含铜离子的有机相,水相中加入过氧化氢氧化亚铁离子为铁离子,氧化三价砷为五价砷,铁离子使得砷转化为FeAsO₄沉淀;滤液调节pH使得剩余铁离子转化为氢氧化铁沉淀得到滤渣2,滤液加入NaF使得钙离子、镁离子转化为氟化钙和氟化镁沉淀得到滤渣3,滤液处理得到NiSO₄·6H₂O。
解析:
(1)镍原子失去2个电子形成Ni²⁺,基态Ni²⁺的价层电子轨道表示式为
 。
。(2)过氧化氢不稳定,受热容易分解,温度不能过高是防止H₂O₂受热分解;加入过氧化氢氧化亚铁离子为铁离子,氧化三价砷为五价砷,铁离子使得五价砷转化为FeAsO₄沉淀,反应为$2H_{3}AsO_{3}+2Fe^{2 + }+3H_{2}O_{2}\xlongequal{}2FeAsO_{4}\downarrow+4H_{2}O + 4H^{+}$。
(3)调pH的目的是进一步去除Fe³⁺,使$c(Fe^{3 + })\leq3.0×10^{-12}mol· L^{-1}$,则$c(OH^{-})=\sqrt[3]{\frac{K_{sp}[Fe(OH)_{3}]}{c(Fe^{3 + })}}=\sqrt[3]{\frac{3.0×10^{-39}}{3.0×10^{-12}}}mol· L^{-1}=1.0×10^{-9}mol· L^{-1}$,pOH = 9,pH = 5;若溶液中$c(Ni^{2 + })=0.05mol· L^{-1}$,则其沉淀所需$c(OH^{-})=\sqrt{\frac{K_{sp}[Ni(OH)_{2}]}{c(Ni^{2 + })}}=\sqrt{\frac{5.0×10^{-16}}{0.05}}mol· L^{-1}=1.0×10^{-7}mol· L^{-1}$,pOH = 7,pH = 7,故需控制pH的范围是5≤pH<7。
(4)由分析,滤渣3的主要成分是CaF₂、MgF₂。
(5)①由表,30~54℃结晶得到NiSO₄·6H₂O,故从NiSO₄溶液获得稳定的NiSO₄·6H₂O晶体的操作依次是蒸发浓缩、冷却至30~54℃结晶、过滤、洗涤、干燥。②26.3gNiSO₄·6H₂O晶体的物质的量为26.3g÷263g·mol⁻¹ = 0.1mol,含有0.6molH₂O,煅烧时剩余固体质量与温度变化曲线如题图所示,200℃时物质减少0.5molH₂O,则得到产物的化学式为NiSO₄·H₂O。
(6)据“均摊法”,晶胞中含$8×\frac{1}{8}+6×\frac{1}{2}=4$个Ni、$12×\frac{1}{4}+1 = 4$个O,则氧化镍晶体的摩尔体积$V_{m}=\frac{a^{3}×10^{-36}}{4}× N_{A}m^{3}· mol^{-1}=\frac{a^{3}×10^{-36}N_{A}}{4}m^{3}· mol^{-1}$。
查看更多完整答案,请扫码查看


