2025年学霸高考黑题化学人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年学霸高考黑题化学人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第6页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
实验室常以 $ SbCl_3 $ 和 $ Cl_2 $ 为原料制备 $ SbCl_5 $,其制备(Ⅰ)和纯化(Ⅱ)的实验装置如图所示。已知:$ SbCl_3 $ 的熔点为 $ 73.4 ℃ $,沸点为 $ 223.5 ℃ $,易水解;$ SbCl_5 $ 的熔点为 $ 3.5 ℃ $,液态 $ SbCl_5 $ 在 $ 140 ℃ $ 时即发生分解,$ 2.9 kPa $ 下沸点为 $ 79 ℃ $,也易水解。下列说法错误的是(
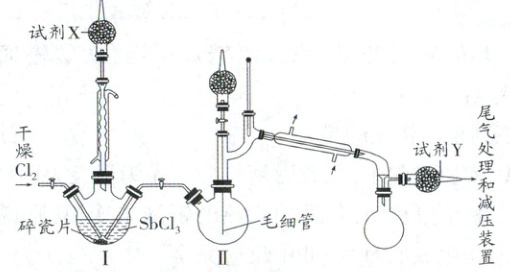
A.实验装置中两种冷凝管可以交换使用
B.试剂 $ X $ 和试剂 $ Y $ 都可以用碱石灰
C.Ⅰ中的碎瓷片和Ⅱ中的毛细管都有防止暴沸的作用
D.Ⅰ中液体进入Ⅱ、Ⅱ中液体的纯化都利用了减压原理
A
)
A.实验装置中两种冷凝管可以交换使用
B.试剂 $ X $ 和试剂 $ Y $ 都可以用碱石灰
C.Ⅰ中的碎瓷片和Ⅱ中的毛细管都有防止暴沸的作用
D.Ⅰ中液体进入Ⅱ、Ⅱ中液体的纯化都利用了减压原理
答案:
巩固训练2A解析:装置I中为球形冷凝管,回流冷凝防止低沸点原料和产品被蒸出,而装置II中的冷凝管在蒸馏时冷凝气体液化收集,两者作用不一致,不能互换,A错误;X和Y均有处理Cl₂尾气的作用,都可选择碱石灰,B正确;液体加热时易暴沸,碎瓷片和毛细管均能防止暴沸,C正确;液态SbCl₅在140℃时即发生分解,所以两步均利用减压蒸馏防止产品分解,D正确。
室温下,下列实验方案能达到实验目的的是(

B
)
答案:
巩固训练3B解析:向5mL1mol·L⁻¹FeI₂溶液中先滴加几滴新制氯水,由于I⁻的还原能力强于Fe²⁺,所以Cl₂先与I⁻反应,滴加几滴KSCN溶液后,溶液不变红色,无法验证氧化性:Cl₂>Fe³⁺,A不能达到实验目的;CH₃COONH₄为弱酸弱碱盐,在水溶液中发生水解相互促进反应,若0.1mol·L⁻¹CH₃COONH₄溶液的pH=7,则$K_{b}(NH_{3}· H_{2}O)=K_{a}(CH_{3}COOH)$,若0.1mol·L⁻¹CH₃COONH₄溶液的pH>7,则$K_{b}(NH_{3}· H_{2}O)>K_{a}(CH_{3}COOH)$,若0.1mol·L⁻¹CH₃COONH₄溶液的pH<7,则$K_{b}(NH_{3}· H_{2}O)<K_{a}(CH_{3}COOH)$,B能达到实验目的;向Na₂CO₃稀溶液中通入足量CO₂气体,发生反应Na₂CO₃+CO₂+H₂O=2NaHCO₃,由于Na₂CO₃为稀溶液,生成的NaHCO₃不一定会达到饱和状态而析出晶体,所以没有明显现象产生,无法验证溶解度:Na₂CO₃>NaHCO₃,C不能达到实验目的;向pH=10的CH₃COONa溶液中加入少量NaCl固体,由于NaCl为强酸盐,不与CH₃COONa反应,也不影响CH₃COONa的水解平衡,溶液的pH不变,所以不能验证CH₃COONa溶液中存在水解平衡,D不能达到实验目的。
利用下列实验装置(加热装置省略)测定葡萄酒中 $ SO_2 $ 的含量,将葡萄酒中的 $ SO_2 $ 吹到 $ H_2O_2 $ 溶液中,用 $ NaOH $ 标准溶液滴定反应后Ⅱ中的溶液。下列说法正确的是(
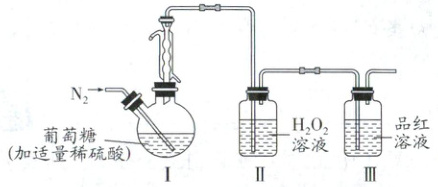
A.Ⅰ中加入稀硫酸,目的是利用其氧化性
B.$ SO_2 $ 进入Ⅱ中与 $ H_2O_2 $ 反应,体现 $ SO_2 $ 的还原性
C.利用 $ NaOH $ 滴定Ⅱ中未反应完的 $ H_2O_2 $,测 $ SO_2 $ 的含量
D.若Ⅲ中溶液颜色变浅,则测得的 $ SO_2 $ 含量偏高
B
)
A.Ⅰ中加入稀硫酸,目的是利用其氧化性
B.$ SO_2 $ 进入Ⅱ中与 $ H_2O_2 $ 反应,体现 $ SO_2 $ 的还原性
C.利用 $ NaOH $ 滴定Ⅱ中未反应完的 $ H_2O_2 $,测 $ SO_2 $ 的含量
D.若Ⅲ中溶液颜色变浅,则测得的 $ SO_2 $ 含量偏高
答案:
巩固训练4B解析:向I中加入稀硫酸,目的是利用其酸性促进二氧化硫逸出,A错误;SO₂进入II中与H₂O₂反应,被氧化为硫酸,体现SO₂的还原性,B正确;利用NaOH滴定II中生成的硫酸,测SO₂的含量,C错误;若III中溶液颜色变浅,说明二氧化硫没有全部被氧化为硫酸,有一部分进入III中,则测得的SO₂含量偏低,D错误。
某小组设计实验探究 $ NaNO_2 $ 的性质,装置如图所示(夹持装置省略)。已知:$ Fe^{2+} + NO = [Fe(NO)]^{2+} $(棕色环)。实验现象:装置乙中产生“棕色环”,装置丙中溶液紫色变浅。下列叙述错误的是(
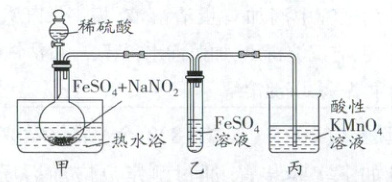
A.通入装置乙中的气体可能有 $ NO $
B.用 $ K_3[Fe(CN)_6] $ 溶液检验装置甲中 $ FeSO_4 $ 是否完全反应
C.可以用含酚酞的纯碱溶液替代装置丙中酸性 $ KMnO_4 $ 溶液
D.其他条件不变,撤去水浴,产生“棕色环”速率变慢
C
)
A.通入装置乙中的气体可能有 $ NO $
B.用 $ K_3[Fe(CN)_6] $ 溶液检验装置甲中 $ FeSO_4 $ 是否完全反应
C.可以用含酚酞的纯碱溶液替代装置丙中酸性 $ KMnO_4 $ 溶液
D.其他条件不变,撤去水浴,产生“棕色环”速率变慢
答案:
巩固训练5C解析:装置乙中产生“棕色环”,说明乙中发生反应Fe²⁺+NO=[Fe(NO)]²⁺,即甲中反应生成的NO通入装置乙中,A正确;$K_{3}[Fe(CN)_{6}]$与Fe²⁺反应生成蓝色沉淀,可用$K_{3}[Fe(CN)_{6}]$溶液检验Fe²⁺的存在,即$K_{3}[Fe(CN)_{6}]$检验装置甲中Fe²⁺是否完全反应,B正确;装置丙中酸性高锰酸钾溶液吸收NO,并检验NO,不能用纯碱溶液吸收NO,C错误;热水浴起加热作用,撤去热水浴,温度降低,反应速率降低,产生“棕色环”速率变慢,D正确。
查看更多完整答案,请扫码查看


