2025年学霸高考黑题化学人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年学霸高考黑题化学人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第71页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
巩固训练5 (2025·甘肃兰州二模)电镀工业废水含有大量的六价铬(CrO₄²⁻、Cr₂O₇²⁻),具有高度的毒性和致癌性,处理工业含铬废水有如下方法:
Ⅰ.还原法。某厂工业含铬废水有少量其他金属离子(Cu²⁺、Ni²⁺、Zn²⁺),现将废水净化并回收金属铬,基本工艺流程如下。回答下列问题:
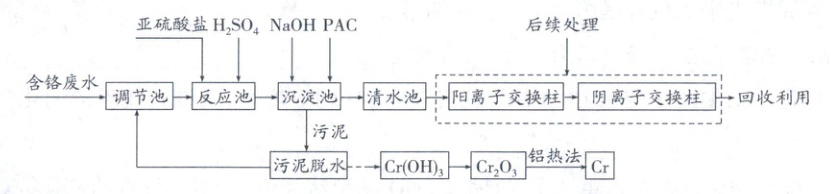
已知:①溶液中CrO₄²⁻和Cr₂O₇²⁻存在平衡:2CrO₄²⁻+2H⁺⇌Cr₂O₇²⁻+H₂O
②常温下,$K_{sp}[Cr(OH)_3]=6.4×10^{-31}$
③几种离子沉淀完全的pH如下表所示:

(1)反应池中溶液的pH=2,亚硫酸盐的作用是
(2)已知Cr³⁺浓度小于1.0×10⁻⁵mol·L⁻¹时沉淀完全。沉淀池的pH一般调整到8.0,此时Cr³⁺
(3)PAC是絮凝剂,Al₂(OH)ₙCl₆₋ₙ是絮凝剂的一种成分,请写出用氢氧化铝与盐酸制备该成分的化学反应方程式
(4)清水池后续深度处理时,可采用离子交换技术(阴、阳离子分别被阴离子交换柱、阳离子交换柱吸收并释放出OH⁻、H⁺)。待净化水先经过阳离子交换柱后再通过阴离子交换柱的原因为
(5)铝热法制备金属Cr的化学方程式为
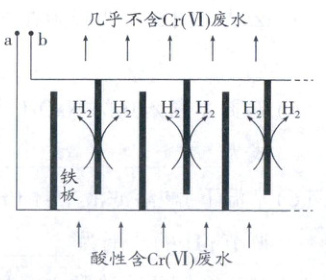
Ⅱ.电解处理技术。用铁板作电极电解处理酸性含铬废水,将Cr(Ⅵ)转化为Cr(OH)₃沉淀(如图所示):
(6)电解时a极连接电源的
(7)电解过程中,阳极区溶液中发生反应的离子方程式为
Ⅰ.还原法。某厂工业含铬废水有少量其他金属离子(Cu²⁺、Ni²⁺、Zn²⁺),现将废水净化并回收金属铬,基本工艺流程如下。回答下列问题:

已知:①溶液中CrO₄²⁻和Cr₂O₇²⁻存在平衡:2CrO₄²⁻+2H⁺⇌Cr₂O₇²⁻+H₂O
②常温下,$K_{sp}[Cr(OH)_3]=6.4×10^{-31}$
③几种离子沉淀完全的pH如下表所示:

(1)反应池中溶液的pH=2,亚硫酸盐的作用是
作还原剂,将重铬酸根离子还原成三价铬离子
。(2)已知Cr³⁺浓度小于1.0×10⁻⁵mol·L⁻¹时沉淀完全。沉淀池的pH一般调整到8.0,此时Cr³⁺
是
(填“是”或“否”)已沉淀完全。(3)PAC是絮凝剂,Al₂(OH)ₙCl₆₋ₙ是絮凝剂的一种成分,请写出用氢氧化铝与盐酸制备该成分的化学反应方程式
2Al(OH)₃+(6-n)HCl══Al₂(OH)ₙCl₆₋ₙ+(6-n)H₂O
。
(4)清水池后续深度处理时,可采用离子交换技术(阴、阳离子分别被阴离子交换柱、阳离子交换柱吸收并释放出OH⁻、H⁺)。待净化水先经过阳离子交换柱后再通过阴离子交换柱的原因为
避免阳离子与阴离子交换柱内OH⁻生成沉淀,降低交换效率
。(5)铝热法制备金属Cr的化学方程式为
Cr₂O₃+2Al══Al₂O₃+2Cr
。Ⅱ.电解处理技术。用铁板作电极电解处理酸性含铬废水,将Cr(Ⅵ)转化为Cr(OH)₃沉淀(如图所示):
(6)电解时a极连接电源的
正
极。(7)电解过程中,阳极区溶液中发生反应的离子方程式为
Cr₂O₇²⁻+6Fe²⁺+14H⁺══2Cr³⁺+6Fe³⁺+7H₂O
。当废水颜色不再变化,切断电源,调高溶液pH,生成沉淀除去铬。
答案:
巩固训练 5
(1)作还原剂,将重铬酸根离子还原成三价铬离子
(2)$2Al(OH)_3+(6 - n)HCl══Al_2(OH)_nCl_{6 - n}+(6 - n)H_2O$
(4)避免阳离子与阴离子交换柱内$OH^-$生成沉淀,降低交换效率
(5)$Cr_2O_3+2Al\xlongequal{高温}Al_2O_3+2Cr$
(6)正
(7)$Cr_2O_7^{2-}+6Fe^{2+}+14H^+══2Cr^{3+}+6Fe^{3+}+7H_2O$
解析:
(1)溶液中$CrO_4^{2-}$和$Cr_2O_7^{2-}$存在平衡:$2CrO_4^{2-}+2H^+⇌Cr_2O_7^{2-}+H_2O$,$pH = 2$时铬元素大部分以$Cr_2O_7^{2-}$形式存在,亚硫酸盐作还原剂,+4 价的硫被+6 价的铬氧化,同时将重铬酸根离子还原成三价铬离子。
(2)沉淀池的$pH = 8$,$c(OH^-)=\frac{10^{-14}}{10^{-8}}=10^{-6}mol· L^{-1}$,此时$c(Cr^{3+})=\frac{K_{sp}[Cr(OH)_3]}{c^3(OH^-)}=\frac{6.4×10^{-31}}{10^{-18}}=6.4×10^{-13}mol· L^{-1}<10^{-5}mol· L^{-1}$,说明$Cr^{3+}$已沉淀完全。
(6)Fe 为阳极失去电子,故电解时 a 极连接电源的正极。
(7)阳极上 Fe 失去电子变为$Fe^{2+}$进入溶液,$Fe^{2+}$具有还原性,被废水中的$Cr_2O_7^{2-}$氧化为$Fe^{3+}$,$Cr_2O_7^{2-}$得到电子被还原产生$Cr^{3+}$,根据得失电子守恒、电荷守恒及原子守恒,写出反应的离子方程式。
(1)作还原剂,将重铬酸根离子还原成三价铬离子
(2)$2Al(OH)_3+(6 - n)HCl══Al_2(OH)_nCl_{6 - n}+(6 - n)H_2O$
(4)避免阳离子与阴离子交换柱内$OH^-$生成沉淀,降低交换效率
(5)$Cr_2O_3+2Al\xlongequal{高温}Al_2O_3+2Cr$
(6)正
(7)$Cr_2O_7^{2-}+6Fe^{2+}+14H^+══2Cr^{3+}+6Fe^{3+}+7H_2O$
解析:
(1)溶液中$CrO_4^{2-}$和$Cr_2O_7^{2-}$存在平衡:$2CrO_4^{2-}+2H^+⇌Cr_2O_7^{2-}+H_2O$,$pH = 2$时铬元素大部分以$Cr_2O_7^{2-}$形式存在,亚硫酸盐作还原剂,+4 价的硫被+6 价的铬氧化,同时将重铬酸根离子还原成三价铬离子。
(2)沉淀池的$pH = 8$,$c(OH^-)=\frac{10^{-14}}{10^{-8}}=10^{-6}mol· L^{-1}$,此时$c(Cr^{3+})=\frac{K_{sp}[Cr(OH)_3]}{c^3(OH^-)}=\frac{6.4×10^{-31}}{10^{-18}}=6.4×10^{-13}mol· L^{-1}<10^{-5}mol· L^{-1}$,说明$Cr^{3+}$已沉淀完全。
(6)Fe 为阳极失去电子,故电解时 a 极连接电源的正极。
(7)阳极上 Fe 失去电子变为$Fe^{2+}$进入溶液,$Fe^{2+}$具有还原性,被废水中的$Cr_2O_7^{2-}$氧化为$Fe^{3+}$,$Cr_2O_7^{2-}$得到电子被还原产生$Cr^{3+}$,根据得失电子守恒、电荷守恒及原子守恒,写出反应的离子方程式。
查看更多完整答案,请扫码查看


