2025年学霸高考黑题化学人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年学霸高考黑题化学人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第79页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
经典真题(结合反应原理类)(2025·陕晋青宁卷,16,14 分)
一种综合回收电解锰工业废盐(主要成分为 $ Mn^{2+} $、$ Mg^{2+} $、$ NH_4^+ $ 的硫酸盐)的工艺流程如下:
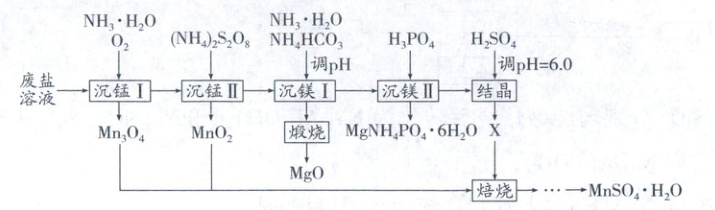
已知:①常温下 $ K_{sp}(MgCO_3) = 10^{-5.17} $,$ K_{sp}[Mg(OH)_2] = 10^{-11.25} $,$ K_{sp}[Mn(OH)_2] = 10^{-12.72} $;

回答下列问题:
(1) 制备废盐溶液时,为加快废盐溶解,可采取的措施有
(2) “沉锰 I”中,写出形成的 $ Mn(OH)_2 $ 被氧化成 $ Mn_3O_4 $ 的化学方程式
(3) “沉锰 II”中,过量的 $ (NH_4)_2S_2O_8 $ 经加热水解去除,最终产物是 $ NH_4HSO_4 $ 和
(4) “沉镁 I”中,当 $ pH $ 为 $ 8.0 \sim 10.2 $ 时,生成碱式碳酸镁 $ [xMgCO_3 · yMg(OH)_2 · zH_2O] $,煅烧得到疏松的轻质 $ MgO $。$ pH $ 过大时,不能得到轻质 $ MgO $ 的原因是
(5) “沉镁 II”中,加 $ H_3PO_4 $ 至 $ pH = 8.0 $ 时,$ Mg^{2+} $ 沉淀完全;若加至 $ pH = 4.0 $ 时沉淀完全溶解,据图分析,写出沉淀溶解的离子方程式

(6) “结晶”中,产物 $ X $ 的化学式为
(7) “焙烧”中,$ Mn $ 元素发生了
一种综合回收电解锰工业废盐(主要成分为 $ Mn^{2+} $、$ Mg^{2+} $、$ NH_4^+ $ 的硫酸盐)的工艺流程如下:

已知:①常温下 $ K_{sp}(MgCO_3) = 10^{-5.17} $,$ K_{sp}[Mg(OH)_2] = 10^{-11.25} $,$ K_{sp}[Mn(OH)_2] = 10^{-12.72} $;

回答下列问题:
(1) 制备废盐溶液时,为加快废盐溶解,可采取的措施有
搅拌
、适当升温等
。(写出两种)(2) “沉锰 I”中,写出形成的 $ Mn(OH)_2 $ 被氧化成 $ Mn_3O_4 $ 的化学方程式
$6Mn(OH)_2+O_2=2Mn_3O_4+6H_2O$
。当 $ Mg^{2+}(c = 10^{-0.68} mol·L^{-1}) $ 将要开始沉淀时,溶液中剩余 $ Mn^{2+} $ 浓度为$10^{-2.15}$
$ mol·L^{-1} $。(3) “沉锰 II”中,过量的 $ (NH_4)_2S_2O_8 $ 经加热水解去除,最终产物是 $ NH_4HSO_4 $ 和
$O_2$
(填化学式)。(4) “沉镁 I”中,当 $ pH $ 为 $ 8.0 \sim 10.2 $ 时,生成碱式碳酸镁 $ [xMgCO_3 · yMg(OH)_2 · zH_2O] $,煅烧得到疏松的轻质 $ MgO $。$ pH $ 过大时,不能得到轻质 $ MgO $ 的原因是
pH过大时,沉淀为$Mg(OH)_2$,不能分解产生$CO_2$,不能得到疏松的轻质$MgO$
。(5) “沉镁 II”中,加 $ H_3PO_4 $ 至 $ pH = 8.0 $ 时,$ Mg^{2+} $ 沉淀完全;若加至 $ pH = 4.0 $ 时沉淀完全溶解,据图分析,写出沉淀溶解的离子方程式
$MgNH_4PO_4·6H_2O+2H_3PO_4=Mg^{2+}+3H_2PO_4^-+NH_4^++6H_2O$
。
(6) “结晶”中,产物 $ X $ 的化学式为
$(NH_4)_2SO_4$
。(7) “焙烧”中,$ Mn $ 元素发生了
还原
(填“氧化”或“还原”)反应。
答案:
经典真题
(1)搅拌 适当升温等
(2)$6Mn(OH)_2+O_2=2Mn_3O_4+6H_2O$ $10^{-2.15}$
(3)$O_2$
(4)pH过大时,沉淀为$Mg(OH)_2$,不能分解产生$CO_2$,不能得到疏松的轻质$MgO$
(5)$MgNH_4PO_4·6H_2O+2H_3PO_4=Mg^{2+}+3H_2PO_4^-+NH_4^++6H_2O$
(6)$(NH_4)_2SO_4$
(7)还原
解题思路
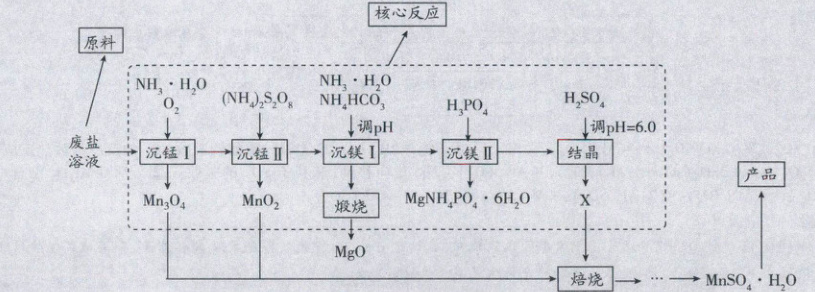
实验步骤 实验原理
沉锰Ⅰ 通入氧气沉锰得到$Mn_3O_4$,发生氧化还原反应:$6Mn(OH)_2+O_2=2Mn_3O_4+6H_2O$
沉锰Ⅱ 加入$(NH_4)_2S_2O_8$沉锰得到$MnO_2$,发生氧化还原反应,过二硫酸根中的过氧键断裂形成硫酸根,过量的$(NH_4)_2S_2O_8$加热水解,生成$NH_4HSO_4$和$H_2O_2$:$(NH_4)_2S_2O_8+2H_2O=2NH_4HSO_4+H_2O_2$,$H_2O_2$分解:$2H_2O_2=2H_2O+O_2↑$,总反应为$2(NH_4)_2S_2O_8+2H_2O=4NH_4HSO_4+O_2↑$,最终产物是$NH_4HSO_4$和$O_2$。
沉镁Ⅰ 加入$NH_4HCO_3$和$NH_3·H_2O$调节pH沉镁得到$MgCO_3$,pH过大时生成碱式碳酸镁
沉镁Ⅱ $MgNH_4PO_4·6H_2O+2H_3PO_4=Mg^{2+}+3H_2PO_4^-+NH_4^++6H_2O$
结晶 溶液加入$H_2SO_4$调节pH=6.0,结晶得到X(硫酸铵)
解析:
(1)加快废盐的溶解可以采取搅拌、适当升温、粉碎等。
(2)$Mn(OH)_2$被$O_2$氧化得到$Mn_3O_4$,化学方程式为$6Mn(OH)_2+O_2=2Mn_3O_4+6H_2O$;根据$\frac{c(Mg^{2+})·K_{sp}[Mg(OH)_2]}{c(Mn^{2+})·K_{sp}[Mn(OH)_2]}=\frac{10^{-0.68}}{10^{-11.25}}·c(Mn^{2+}) = 10^{-2.15}mol·L^{-1}$。
(3)“沉锰Ⅱ”中,过量的$(NH_4)_2S_2O_8$经热水解去除,$(NH_4)_2S_2O_8$中存在过氧键,在加热和水存在下发生水解,生成$NH_4HSO_4$和$H_2O_2$:$(NH_4)_2S_2O_8+2H_2O=2NH_4HSO_4+H_2O_2$,$H_2O_2$分解:$2H_2O_2=2H_2O+O_2↑$,总反应为$2(NH_4)_2S_2O_8+2H_2O=4NH_4HSO_4+O_2↑$,最终产物是$NH_4HSO_4$和$O_2$。
(4)$[xMgCO_3·yMg(OH)_2·zH_2O]$煅烧有$CO_2$生成,可以得到疏松的轻质氧化镁,pH过大,沉淀为$Mg(OH)_2$,不能分解产生$CO_2$,不能得到疏松的轻质$MgO$。
(5)由题中信息可知,pH=8.0时,产生的沉淀为$MgNH_4PO_4·6H_2O$,调节pH=4,磷元素存在形式为$H_3PO_4$,磷酸不是强酸,不能拆,离子方程式为$MgNH_4PO_4·6H_2O+2H_3PO_4=Mg^{2+}+3H_2PO_4^-+NH_4^++6H_2O$。
(6)溶液中存在铵根离子和硫酸根离子,结晶后为$(NH_4)_2SO_4$。
(7)“焙烧”中,$MnO_2$最终生成$MnSO_4·H_2O$,Mn元素化合价降低,发生了还原反应。
经典真题
(1)搅拌 适当升温等
(2)$6Mn(OH)_2+O_2=2Mn_3O_4+6H_2O$ $10^{-2.15}$
(3)$O_2$
(4)pH过大时,沉淀为$Mg(OH)_2$,不能分解产生$CO_2$,不能得到疏松的轻质$MgO$
(5)$MgNH_4PO_4·6H_2O+2H_3PO_4=Mg^{2+}+3H_2PO_4^-+NH_4^++6H_2O$
(6)$(NH_4)_2SO_4$
(7)还原
解题思路

实验步骤 实验原理
沉锰Ⅰ 通入氧气沉锰得到$Mn_3O_4$,发生氧化还原反应:$6Mn(OH)_2+O_2=2Mn_3O_4+6H_2O$
沉锰Ⅱ 加入$(NH_4)_2S_2O_8$沉锰得到$MnO_2$,发生氧化还原反应,过二硫酸根中的过氧键断裂形成硫酸根,过量的$(NH_4)_2S_2O_8$加热水解,生成$NH_4HSO_4$和$H_2O_2$:$(NH_4)_2S_2O_8+2H_2O=2NH_4HSO_4+H_2O_2$,$H_2O_2$分解:$2H_2O_2=2H_2O+O_2↑$,总反应为$2(NH_4)_2S_2O_8+2H_2O=4NH_4HSO_4+O_2↑$,最终产物是$NH_4HSO_4$和$O_2$。
沉镁Ⅰ 加入$NH_4HCO_3$和$NH_3·H_2O$调节pH沉镁得到$MgCO_3$,pH过大时生成碱式碳酸镁
沉镁Ⅱ $MgNH_4PO_4·6H_2O+2H_3PO_4=Mg^{2+}+3H_2PO_4^-+NH_4^++6H_2O$
结晶 溶液加入$H_2SO_4$调节pH=6.0,结晶得到X(硫酸铵)
解析:
(1)加快废盐的溶解可以采取搅拌、适当升温、粉碎等。
(2)$Mn(OH)_2$被$O_2$氧化得到$Mn_3O_4$,化学方程式为$6Mn(OH)_2+O_2=2Mn_3O_4+6H_2O$;根据$\frac{c(Mg^{2+})·K_{sp}[Mg(OH)_2]}{c(Mn^{2+})·K_{sp}[Mn(OH)_2]}=\frac{10^{-0.68}}{10^{-11.25}}·c(Mn^{2+}) = 10^{-2.15}mol·L^{-1}$。
(3)“沉锰Ⅱ”中,过量的$(NH_4)_2S_2O_8$经热水解去除,$(NH_4)_2S_2O_8$中存在过氧键,在加热和水存在下发生水解,生成$NH_4HSO_4$和$H_2O_2$:$(NH_4)_2S_2O_8+2H_2O=2NH_4HSO_4+H_2O_2$,$H_2O_2$分解:$2H_2O_2=2H_2O+O_2↑$,总反应为$2(NH_4)_2S_2O_8+2H_2O=4NH_4HSO_4+O_2↑$,最终产物是$NH_4HSO_4$和$O_2$。
(4)$[xMgCO_3·yMg(OH)_2·zH_2O]$煅烧有$CO_2$生成,可以得到疏松的轻质氧化镁,pH过大,沉淀为$Mg(OH)_2$,不能分解产生$CO_2$,不能得到疏松的轻质$MgO$。
(5)由题中信息可知,pH=8.0时,产生的沉淀为$MgNH_4PO_4·6H_2O$,调节pH=4,磷元素存在形式为$H_3PO_4$,磷酸不是强酸,不能拆,离子方程式为$MgNH_4PO_4·6H_2O+2H_3PO_4=Mg^{2+}+3H_2PO_4^-+NH_4^++6H_2O$。
(6)溶液中存在铵根离子和硫酸根离子,结晶后为$(NH_4)_2SO_4$。
(7)“焙烧”中,$MnO_2$最终生成$MnSO_4·H_2O$,Mn元素化合价降低,发生了还原反应。
$ Na_2Cr_2O_7 · 2H_2O $ 是一种重要的化工原料,可用于制革、印染等工业。
(1) 以铬铁矿(主要成分为 $ FeO · Cr_2O_3 $,还含有 $ MgO $、$ Al_2O_3 $、$ SiO_2 $ 等)为原料制备 $ Na_2Cr_2O_7 · 2H_2O $ 的工艺流程如图。
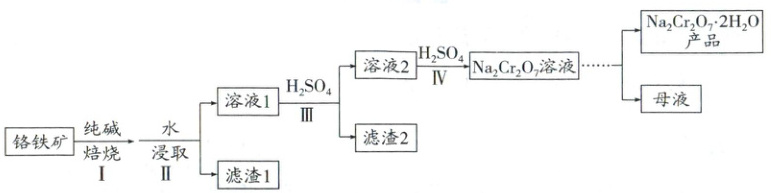
已知:$ Al_2O_3 $、$ SiO_2 $ 分别与纯碱焙烧后转化为 $ Na[Al(OH)_4] $ 和 $ Na_2SiO_3 $,$ Na[Al(OH)_4] $ 在水溶液中的存在形式为 $ Na[Al(OH)_4] $。
① 焙烧时将矿料磨碎且气体与矿料逆流而行,其目的是
② 焙烧的目的是将 $ FeO · Cr_2O_3 $ 转化为 $ Na_2CrO_4 $,并将 $ Al $、$ Si $ 的氧化物转化为可溶性钠盐,写出焙烧时 $ FeO · Cr_2O_3 $ 发生反应的化学方程式
③ 滤渣 1 主要含有
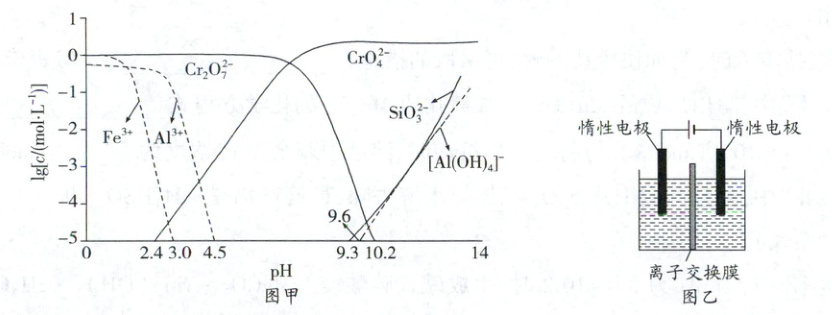
④ 矿物中相关元素可溶性组分的物质的量浓度 $ c $ 与 $ pH $ 的关系如图甲所示。
i. 过程 III 中使用 $ H_2SO_4 $ 溶液的目的是
ii. 过程 IV 发生反应 $ 2CrO_4^{2-} + 2H^+ \rightleftharpoons Cr_2O_7^{2-} + H_2O $,计算该反应的 $ K$
(2) 利用膜电解技术,以 $ Na_2CrO_4 $ 溶液为阳极室电解质溶液,$ NaOH $ 溶液为阴极室电解质溶液也可以制备 $ Na_2Cr_2O_7 $,装置如图乙所示。已知:酸性条件下 $ Cr_2O_7^{2-} $ 被还原为 $ Cr^{3+} $。
① 离子交换膜应该选用
a. 阴离子交换膜
b. 质子交换膜
c. 阳离子交换膜
② 结合方程式解释 $ Na_2Cr_2O_7 $ 产生的原理
(1) 以铬铁矿(主要成分为 $ FeO · Cr_2O_3 $,还含有 $ MgO $、$ Al_2O_3 $、$ SiO_2 $ 等)为原料制备 $ Na_2Cr_2O_7 · 2H_2O $ 的工艺流程如图。

已知:$ Al_2O_3 $、$ SiO_2 $ 分别与纯碱焙烧后转化为 $ Na[Al(OH)_4] $ 和 $ Na_2SiO_3 $,$ Na[Al(OH)_4] $ 在水溶液中的存在形式为 $ Na[Al(OH)_4] $。
① 焙烧时将矿料磨碎且气体与矿料逆流而行,其目的是
增大接触面积,提高反应速率,使矿石充分反应
。② 焙烧的目的是将 $ FeO · Cr_2O_3 $ 转化为 $ Na_2CrO_4 $,并将 $ Al $、$ Si $ 的氧化物转化为可溶性钠盐,写出焙烧时 $ FeO · Cr_2O_3 $ 发生反应的化学方程式
$4FeO·Cr_2O_3+8Na_2CO_3+7O_2\xlongequal{高温}8Na_2CrO_4+2Fe_2O_3+8CO_2↑$
。③ 滤渣 1 主要含有
$Fe_2O_3$和$MgO$
。④ 矿物中相关元素可溶性组分的物质的量浓度 $ c $ 与 $ pH $ 的关系如图甲所示。
i. 过程 III 中使用 $ H_2SO_4 $ 溶液的目的是
调节溶液pH使$SiO_3^{2-}$与$[Al(OH)_4]^-$转化为沉淀除去
,$ pH $ 的理论范围为4.5~9.3
。ii. 过程 IV 发生反应 $ 2CrO_4^{2-} + 2H^+ \rightleftharpoons Cr_2O_7^{2-} + H_2O $,计算该反应的 $ K$
$10^{14.8}$
$\approx $ 。(2) 利用膜电解技术,以 $ Na_2CrO_4 $ 溶液为阳极室电解质溶液,$ NaOH $ 溶液为阴极室电解质溶液也可以制备 $ Na_2Cr_2O_7 $,装置如图乙所示。已知:酸性条件下 $ Cr_2O_7^{2-} $ 被还原为 $ Cr^{3+} $。
① 离子交换膜应该选用
c
(填字母)。a. 阴离子交换膜
b. 质子交换膜
c. 阳离子交换膜
② 结合方程式解释 $ Na_2Cr_2O_7 $ 产生的原理
阳极反应为$2H_2O - 4e^-=O_2↑ + 4H^+$,$c(H^+)$增大,促进平衡$2CrO_4^{2-}+2H^+\rightleftharpoons Cr_2O_7^{2-}+H_2O$正向移动,产生$Cr_2O_7^{2-}$,同时部分$Na^+$移向阴极区,在阳极生成$Na_2Cr_2O_7$
。
答案:
巩固训练1
(1)①增大接触面积,提高反应速率,使矿石充分反应 ②$4FeO·Cr_2O_3+8Na_2CO_3+7O_2\xlongequal{高温}8Na_2CrO_4+2Fe_2O_3+8CO_2↑$ ③$Fe_2O_3$和$MgO$ ④i.调节溶液pH使$SiO_3^{2-}$与$[Al(OH)_4]^-$转化为沉淀除去 4.5~9.3 ii.$10^{14.8}$
(2)①c ②阳极反应为$2H_2O - 4e^-=O_2↑ + 4H^+$,$c(H^+)$增大,促进平衡$2CrO_4^{2-}+2H^+\rightleftharpoons Cr_2O_7^{2-}+H_2O$正向移动,产生$Cr_2O_7^{2-}$,同时部分$Na^+$移向阴极区,在阳极生成$Na_2Cr_2O_7$
解题思路
铬铁矿(主要成分为$FeO·Cr_2O_3$,还含有$MgO$、$Al_2O_3$、$SiO_2$等)加入纯碱焙烧,生成$Na_2CrO_4$、$Na[Al(OH)_4]$、$Na_2SiO_3$等,FeO转化为$Fe_2O_3$,$MgO$不反应;加水浸取后,滤渣1为$Fe_2O_3$、$MgO$;滤液中加入$H_2SO_4$后过滤,溶液2为$Na_2CrO_4$溶液,滤渣2为$Al(OH)_3$、$H_2SiO_3$等;$Na_2CrO_4$溶液中继续加入$H_2SO_4$,最终转化为$Na_2Cr_2O_7$。
解析:
(1)④ii.过程Ⅳ发生反应$2CrO_4^{2-}+2H^+\rightleftharpoons Cr_2O_7^{2-}+H_2O$,我们选择pH=2.4的点,此时$c(Cr_2O_7^{2-}) = 1mol·L^{-1}$,$c(CrO_4^{2-}) = 10^{-5}mol·L^{-1}$,$c(H^+)=10^{-2.4}mol·L^{-1}$,该反应的$K=\frac{1}{(10^{-5})^2×(10^{-2.4})^2}=10^{14.8}$。
(2)利用膜电解技术,以$Na_2CrO_4$溶液为阳极室电解质溶液,$NaOH$溶液为阴极室电解质溶液也可以制备$Na_2Cr_2O_7$,则阳极发生反应$2H_2O - 4e^-=O_2↑ + 4H^+$,溶液的酸性增强,发生$2CrO_4^{2-}+2H^+\rightleftharpoons Cr_2O_7^{2-}+H_2O$的转化,阴极发生反应$4H_2O+4e^-=2H_2↑ + 4OH^-$,阳极中的$Na^+$、$H^+$会向阴极迁移。
技巧点拨
电化学原理分析技巧

(1)原电池模型
活泼金属电极、燃料、还原性物质等,物质中有元素化合价升高
观察闭合回路特征
发生氧化反应 负 阴离子移向 电解质 阳离子移向 正 发生还原反应 $O_2$、氧化性物质等,物质中有元素化合价降低
观察两极材料或通入物质、反应特征
(2)电解池模型
阳离子转化为单质;阴离子中部分元素的化合价降低,如$SO_4^{2-}\longrightarrow S_2O_5^{2-}$
发生还原反应 阴 阳 极 移 阳 极 移 向 极
观察闭合回路特征
发生氧化反应
活泼电极(Pt、Au或石墨):溶液中的物质失电子
阳极反应
巩固训练1
(1)①增大接触面积,提高反应速率,使矿石充分反应 ②$4FeO·Cr_2O_3+8Na_2CO_3+7O_2\xlongequal{高温}8Na_2CrO_4+2Fe_2O_3+8CO_2↑$ ③$Fe_2O_3$和$MgO$ ④i.调节溶液pH使$SiO_3^{2-}$与$[Al(OH)_4]^-$转化为沉淀除去 4.5~9.3 ii.$10^{14.8}$
(2)①c ②阳极反应为$2H_2O - 4e^-=O_2↑ + 4H^+$,$c(H^+)$增大,促进平衡$2CrO_4^{2-}+2H^+\rightleftharpoons Cr_2O_7^{2-}+H_2O$正向移动,产生$Cr_2O_7^{2-}$,同时部分$Na^+$移向阴极区,在阳极生成$Na_2Cr_2O_7$
解题思路
铬铁矿(主要成分为$FeO·Cr_2O_3$,还含有$MgO$、$Al_2O_3$、$SiO_2$等)加入纯碱焙烧,生成$Na_2CrO_4$、$Na[Al(OH)_4]$、$Na_2SiO_3$等,FeO转化为$Fe_2O_3$,$MgO$不反应;加水浸取后,滤渣1为$Fe_2O_3$、$MgO$;滤液中加入$H_2SO_4$后过滤,溶液2为$Na_2CrO_4$溶液,滤渣2为$Al(OH)_3$、$H_2SiO_3$等;$Na_2CrO_4$溶液中继续加入$H_2SO_4$,最终转化为$Na_2Cr_2O_7$。
解析:
(1)④ii.过程Ⅳ发生反应$2CrO_4^{2-}+2H^+\rightleftharpoons Cr_2O_7^{2-}+H_2O$,我们选择pH=2.4的点,此时$c(Cr_2O_7^{2-}) = 1mol·L^{-1}$,$c(CrO_4^{2-}) = 10^{-5}mol·L^{-1}$,$c(H^+)=10^{-2.4}mol·L^{-1}$,该反应的$K=\frac{1}{(10^{-5})^2×(10^{-2.4})^2}=10^{14.8}$。
(2)利用膜电解技术,以$Na_2CrO_4$溶液为阳极室电解质溶液,$NaOH$溶液为阴极室电解质溶液也可以制备$Na_2Cr_2O_7$,则阳极发生反应$2H_2O - 4e^-=O_2↑ + 4H^+$,溶液的酸性增强,发生$2CrO_4^{2-}+2H^+\rightleftharpoons Cr_2O_7^{2-}+H_2O$的转化,阴极发生反应$4H_2O+4e^-=2H_2↑ + 4OH^-$,阳极中的$Na^+$、$H^+$会向阴极迁移。
技巧点拨
电化学原理分析技巧

(1)原电池模型
活泼金属电极、燃料、还原性物质等,物质中有元素化合价升高
观察闭合回路特征
发生氧化反应 负 阴离子移向 电解质 阳离子移向 正 发生还原反应 $O_2$、氧化性物质等,物质中有元素化合价降低
观察两极材料或通入物质、反应特征
(2)电解池模型
阳离子转化为单质;阴离子中部分元素的化合价降低,如$SO_4^{2-}\longrightarrow S_2O_5^{2-}$
发生还原反应 阴 阳 极 移 阳 极 移 向 极
观察闭合回路特征
发生氧化反应
活泼电极(Pt、Au或石墨):溶液中的物质失电子
阳极反应
查看更多完整答案,请扫码查看


