2025年学霸高考黑题化学人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年学霸高考黑题化学人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第14页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
强酸性环境下,Fe³⁺与磺基水杨酸( ,用 H₃L 表示)反应仅生成配合物 FeL·2H₂O(溶液呈紫红色)。在 pH = 2 的 HClO₄ 溶液中,保持 c₍总₎ = c(Fe³⁺) + c(H₃L) = 0.006 mol·L⁻¹,用分光光度计对混合溶液的吸光度(A)进行测定,得到溶液吸光度与起始 Fe³⁺物质的量分数的关系如图所示。下列叙述错误的是(
,用 H₃L 表示)反应仅生成配合物 FeL·2H₂O(溶液呈紫红色)。在 pH = 2 的 HClO₄ 溶液中,保持 c₍总₎ = c(Fe³⁺) + c(H₃L) = 0.006 mol·L⁻¹,用分光光度计对混合溶液的吸光度(A)进行测定,得到溶液吸光度与起始 Fe³⁺物质的量分数的关系如图所示。下列叙述错误的是(
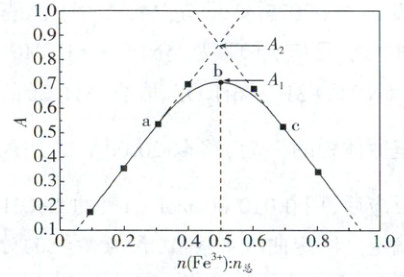
已知:①稀溶液中 Fe³⁺近乎无色;②溶液吸光度 A 与配合物浓度成正比。
A.H₃L 中三种基团电离出 H⁺的容易程度:—SO₃H > —COOH > —OH
B.b 点溶液中存在 FeL ⇌ Fe³⁺ + L³⁻,FeL 的电离度 α = (A₂ - A₁)/A₂
C.Fe³⁺可以促进 H₃L 的电离,H₃L 的电离度:a 点 < b 点 < c 点
D.若 A₂ = 0.84、A₁ = 0.70,则 FeL ⇌ Fe³⁺ + L³⁻的电离平衡常数 K 为 10⁻⁶
 ,用 H₃L 表示)反应仅生成配合物 FeL·2H₂O(溶液呈紫红色)。在 pH = 2 的 HClO₄ 溶液中,保持 c₍总₎ = c(Fe³⁺) + c(H₃L) = 0.006 mol·L⁻¹,用分光光度计对混合溶液的吸光度(A)进行测定,得到溶液吸光度与起始 Fe³⁺物质的量分数的关系如图所示。下列叙述错误的是(
,用 H₃L 表示)反应仅生成配合物 FeL·2H₂O(溶液呈紫红色)。在 pH = 2 的 HClO₄ 溶液中,保持 c₍总₎ = c(Fe³⁺) + c(H₃L) = 0.006 mol·L⁻¹,用分光光度计对混合溶液的吸光度(A)进行测定,得到溶液吸光度与起始 Fe³⁺物质的量分数的关系如图所示。下列叙述错误的是(D
)
已知:①稀溶液中 Fe³⁺近乎无色;②溶液吸光度 A 与配合物浓度成正比。
A.H₃L 中三种基团电离出 H⁺的容易程度:—SO₃H > —COOH > —OH
B.b 点溶液中存在 FeL ⇌ Fe³⁺ + L³⁻,FeL 的电离度 α = (A₂ - A₁)/A₂
C.Fe³⁺可以促进 H₃L 的电离,H₃L 的电离度:a 点 < b 点 < c 点
D.若 A₂ = 0.84、A₁ = 0.70,则 FeL ⇌ Fe³⁺ + L³⁻的电离平衡常数 K 为 10⁻⁶
答案:
巩固训练1D 解析:—$\mathrm{SO_3H}$、—$\mathrm{COOH}$、—$\mathrm{OH}$中非羟基氧数目由多到少,非羟基氧数目越多,氧的吸电子效应越强,导致$\mathrm{O—H}$键极性增大,$\mathrm{H^+}$更易电离,$\mathrm{H_3L}$中三种基团电离出$\mathrm{H^+}$的容易程度:—$\mathrm{SO_3H} > —\mathrm{COOH} > —\mathrm{OH}$,A正确;由b点$n(\mathrm{Fe^{3+}}) : n_\Sigma = 0.5$可知,$n(\mathrm{Fe^{3+}}) = n(\mathrm{H_3L})$,二者恰好完全反应,此时溶质为FeL,由题意知若FeL不电离(假定浓度为$c_2$),其吸光度为$A_2$;实际电离后剩余的FeL(假定浓度为$c_1$)的吸光度为$A_1$,则电离度$\alpha = \frac{c_2 - c_1}{c_2} = \frac{A_2 - A_1}{A_2}$,B正确;随FeL·$2\mathrm{H_2O}$的生成,$\mathrm{H_3L}$的电离平衡正移,$\mathrm{Fe^{3+}}$促进$\mathrm{H_3L}$的电离,$\mathrm{Fe^{3+}}$浓度越大,$\mathrm{H_3L}$的电离度越大,即$\mathrm{H_3L}$的电离度:a点<b点<c点,C正确;由b点FeL的起始浓度($c_1 = 0.003 \mathrm{mol · L^{-1}}$)、电离度与电离平衡常数的关系可知,$K = \frac{c(\mathrm{Fe^{3+}}) × c^2(\mathrm{L^{-}})}{c(\mathrm{FeL})} = \frac{(c_1 \alpha)^2 × c_1 \alpha^2}{c_1 (1 - \alpha)} , \alpha = \frac{A_2 - A_1}{A_2}$,将$c_1 = 0.003 \mathrm{mol · L^{-1}}$、$A_2 = 0.84$、$A_1 = 0.70$代入,解得$K = 10^{-4}$,D错误。
工业上用氨气调节 pH 去除酸性废水中的铅。常温时,原溶液中含铅微粒的总物质的量浓度为 0.01 mol·L⁻¹,各含铅微粒的物质的量分数 α 与 pH 的关系如图所示[已知:NH₃·H₂O 的 Kb = 1.74×10⁻⁵,Pb(OH)₂难溶于水,10⁻⁰.² ≈ 0.63,忽略溶液体积的变化]。下列说法正确的是(

A.pH 越大,除铅效果越好
B.pH = 8 时,溶液中的氨主要以 NH₃·H₂O 的形式存在
C.Ksp[Pb(OH)₂] = 2.6×10⁻¹³
D.Pb(OH)⁺(aq) ⇌ Pb²⁺(aq) + OH⁻(aq)的平衡常数为 10⁻⁶.¹
D
)
A.pH 越大,除铅效果越好
B.pH = 8 时,溶液中的氨主要以 NH₃·H₂O 的形式存在
C.Ksp[Pb(OH)₂] = 2.6×10⁻¹³
D.Pb(OH)⁺(aq) ⇌ Pb²⁺(aq) + OH⁻(aq)的平衡常数为 10⁻⁶.¹
答案:
巩固训练2D 解析:从图像可知,当pH过大时,会生成$\mathrm{Pb(OH)_2}$、$\mathrm{Pb(OH)_4}$等含铅微粒,并非pH越大除铅效果越好,因为这些含铅微粒仍存在于溶液中,A错误;已知$\mathrm{NH_3 · H_2O}$的$K_b = 1.74 × 10^{-5}$,当pH = 8时,$c(\mathrm{OH^-}) = 10^{-6} \mathrm{mol · L^{-1}}$,根据$K_b = \frac{c(\mathrm{NH_4^+}) × c(\mathrm{OH^-})}{c(\mathrm{NH_3 · H_2O})}$可得$\frac{c(\mathrm{NH_4^+})}{c(\mathrm{NH_3 · H_2O})} = \frac{K_b}{c(\mathrm{OH^-})} = \frac{1.74 × 10^{-5}}{10^{-6}} = 17.4$,说明溶液中的氨主要以$\mathrm{NH_4^+}$的形式存在,B错误;由题干图像可知,当pH = 7.9时,含铅微粒为$\mathrm{Pb(OH)_2}$、$\mathrm{Pb^{2+}}$和$\mathrm{Pb(OH)_3^-}$,则$\mathrm{Pb^{2+}}$的浓度为$0.01 \mathrm{mol · L^{-1}} × 0.42 = 0.0042 \mathrm{mol · L^{-1}}$,$c(\mathrm{OH^-}) = 10^{-6.1} \mathrm{mol · L^{-1}}$,则$K_{sp} [\mathrm{Pb(OH)_2}] = c(\mathrm{Pb^{2+}}) × c^2(\mathrm{OH^-}) = 0.0042 × (10^{-6.1})^2 = 0.0042 × 10^{-12.2} = 0.0042 × 6.3 × 10^{-13} = 2.646 × 10^{-15}$,C错误;$\mathrm{Pb(OH)_3^- (aq) \rightleftharpoons Pb^{2+} (aq) + OH^- (aq)}$的平衡常数$K = \frac{c(\mathrm{Pb^{2+}}) × c(\mathrm{OH^-})}{c(\mathrm{Pb(OH)_3^-})}$,由图像可知,当pH = 7.9时,$c(\mathrm{Pb^{2+}}) = c(\mathrm{Pb(OH)_3^-})$,此时$c(\mathrm{OH^-}) = 10^{-6.1}$,故$K = 10^{-6.1}$,D正确。
25℃时,将 HCl 气体缓慢通入 0.1 mol·L⁻¹ 的氨水中,溶液的 pH、体系中粒子浓度的对数值(lgc)与反应物的物质的量之比[t = n(HCl)/n(NH₃·H₂O)]的关系如图所示。若忽略溶液体积变化,下列有关说法正确的是(

A.25℃时,Kb(NH₃·H₂O) = 10⁻⁹.²⁵
B.P₂ 所示溶液:c(NH₄⁺) < 100c(NH₃·H₂O)
C.t = 0.5 时,c(NH₃·H₂O) > c(Cl⁻) > c(NH₄⁺)
D.P₁ 所示溶液:c(NH₄⁺) = c(NH₃·H₂O) = 0.05 mol·L⁻¹
D
)
A.25℃时,Kb(NH₃·H₂O) = 10⁻⁹.²⁵
B.P₂ 所示溶液:c(NH₄⁺) < 100c(NH₃·H₂O)
C.t = 0.5 时,c(NH₃·H₂O) > c(Cl⁻) > c(NH₄⁺)
D.P₁ 所示溶液:c(NH₄⁺) = c(NH₃·H₂O) = 0.05 mol·L⁻¹
答案:
巩固训练3D 解析:由图可知$P_1$时,$\mathrm{NH_4^+}$和$\mathrm{NH_3 · H_2O}$的浓度相同,$P_2$时溶液显中性,$\mathrm{H^+}$和$\mathrm{OH^-}$的浓度相同,结合$\mathrm{NH_3 · H_2O}$的电离常数的表达式$K_b = \frac{c(\mathrm{NH_4^+}) × c(\mathrm{OH^-})}{c(\mathrm{NH_3 · H_2O})}$。根据$P_1$时$\mathrm{NH_4^+}$和$\mathrm{NH_3 · H_2O}$的浓度相同,且pH = 9.25,$c(\mathrm{OH^-}) = 10^{-4.75} \mathrm{mol · L^{-1}}$,$K_b = \frac{c(\mathrm{NH_4^+}) × c(\mathrm{OH^-})}{c(\mathrm{NH_3 · H_2O})} = 10^{-4.75}$,A错误;根据$P_2$时溶液显中性,$c(\mathrm{OH^-}) = 10^{-7} \mathrm{mol · L^{-1}}$,结合$K_b = \frac{c(\mathrm{NH_4^+}) × c(\mathrm{OH^-})}{c(\mathrm{NH_3 · H_2O})} = 10^{-4.75}$,$c(\mathrm{NH_4^+}) = \frac{10^{-4.75}}{10^{-7}} × c(\mathrm{NH_3 · H_2O}) = 10^{2.25} > 100c(\mathrm{NH_3 · H_2O})$,B错误;$t = \frac{n(\mathrm{HCl})}{n(\mathrm{NH_3 · H_2O})} = 0.5$时,溶液中溶质为等浓度的$\mathrm{NH_4Cl}$和$\mathrm{NH_3 · H_2O}$,由图可知溶液此时显碱性,则$\mathrm{NH_3 · H_2O}$的电离程度大于$\mathrm{NH_4^+}$的水解程度,此时溶液中离子浓度大小顺序为$c(\mathrm{NH_4^+}) > c(\mathrm{Cl^-}) > c(\mathrm{NH_3 · H_2O}) > c(\mathrm{OH^-}) > c(\mathrm{H^+})$,C错误;根据氮原子守恒,$c(\mathrm{NH_4^+}) + c(\mathrm{NH_3 · H_2O}) = 0.1 \mathrm{mol · L^{-1}}$,而$P_1$时,$\mathrm{NH_4^+}$和$\mathrm{NH_3 · H_2O}$的浓度相同,故$c(\mathrm{NH_4^+}) = c(\mathrm{NH_3 · H_2O}) = 0.05 \mathrm{mol · L^{-1}}$,D正确。
查看更多完整答案,请扫码查看


