2025年学霸高考黑题化学人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年学霸高考黑题化学人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第41页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
经典真题1 重量法
(2025·湖北,18,14分)某小组在探究Cu²⁺的还原产物组成及其形态过程中,观察到的实验现象与理论预测有差异。根据实验描述,回答下列问题:
(1)向2mL10%NaOH溶液加入5滴5%CuSO₄溶液,振荡后加入2mL10%葡萄糖溶液,加热。
①反应产生的砖红色沉淀为
②操作时,没有加入葡萄糖溶液就加热,有黑色沉淀生成。用化学反应方程式说明该沉淀产生的原因:
(2)向20mL0.5mol·L⁻¹CuSO₄溶液中加入Zn粉使蓝色完全褪去,再加入盐酸并加热至溶液中无气泡产生为止。过滤得固体,洗涤并真空干燥。
①加入盐酸的目的是
②同学甲一次性加入1.18gZn粉,得到0.78g红棕色固体,其组成是
a.Cu
b.Cu包裹Zn
c.CuO
d.Cu和Cu₂O
③同学乙搅拌下分批加入1.18gZn粉,得到黑色粉末X。分析结果表明,X中不含Zn和Cu(Ⅰ)。关于X的组成提出了三种可能性:Ⅰ.CuO;Ⅱ.CuO和Cu;Ⅲ.Cu,开展了下面2个探究实验:

由实验结果可知,X的组成是
(2025·湖北,18,14分)某小组在探究Cu²⁺的还原产物组成及其形态过程中,观察到的实验现象与理论预测有差异。根据实验描述,回答下列问题:
(1)向2mL10%NaOH溶液加入5滴5%CuSO₄溶液,振荡后加入2mL10%葡萄糖溶液,加热。
①反应产生的砖红色沉淀为
$\mathrm{Cu_2O}$
(写化学式),葡萄糖表现出还原
(填“氧化”或“还原”)性。②操作时,没有加入葡萄糖溶液就加热,有黑色沉淀生成。用化学反应方程式说明该沉淀产生的原因:
$\mathrm{Cu(OH)_2\xlongequal{\triangle}CuO + H_2O}$
。(2)向20mL0.5mol·L⁻¹CuSO₄溶液中加入Zn粉使蓝色完全褪去,再加入盐酸并加热至溶液中无气泡产生为止。过滤得固体,洗涤并真空干燥。
①加入盐酸的目的是
除去过量的锌粉
。②同学甲一次性加入1.18gZn粉,得到0.78g红棕色固体,其组成是
b
(填字母)。a.Cu
b.Cu包裹Zn
c.CuO
d.Cu和Cu₂O
③同学乙搅拌下分批加入1.18gZn粉,得到黑色粉末X。分析结果表明,X中不含Zn和Cu(Ⅰ)。关于X的组成提出了三种可能性:Ⅰ.CuO;Ⅱ.CuO和Cu;Ⅲ.Cu,开展了下面2个探究实验:

由实验结果可知,X的组成是
Ⅲ
(填“Ⅰ”“Ⅱ”或“Ⅲ”)。从物质形态角度分析,X为黑色的原因是光线进入后被多次反射吸收,所以呈黑色
。
答案:
经典真题1
(1)①$\mathrm{Cu_2O}$还原②$\mathrm{Cu(OH)_2\xlongequal{\triangle}CuO + H_2O}$
(2)①除去过量的锌粉②b③Ⅲ 光线进入后被多次反射吸收,所以呈黑色
解题思路

得到的溶液呈无色,说明一定无$\mathrm{CuO}$,那么X的组成只能是$\mathrm{Cu}$
实验1
1)足量稀$\mathrm{H_2SO_4}$ 2)足量$\mathrm{NH_3· H_2O}$
无色溶液+黑色粉末
实验2
足量$\mathrm{HNO_3}$
蓝色溶液
$\mathrm{Cu}$和稀$\mathrm{HNO_3}$反应生成蓝色的$\mathrm{Cu(NO_3)_2}$溶液:
$3\mathrm{Cu}+8\mathrm{HNO_3}=3\mathrm{Cu(NO_3)_2}+2\mathrm{NO}\uparrow+4\mathrm{H_2O}$
解析:
(1)①新制氢氧化铜悬浊液与葡萄糖中的醛基反应产生的砖红色沉淀为$\mathrm{Cu_2O}$,$\mathrm{Cu}$被葡萄糖从 +2 价还原为 +1 价,葡萄糖表现出还原性;②生成的黑色沉淀为$\mathrm{CuO}$,反应的化学方程式为$\mathrm{Cu(OH)_2\xlongequal{\triangle}CuO + H_2O}$。
(2)①由题干加入盐酸并加热至溶液中无气泡产生为止可知,加入盐酸的作用是除去过量的锌粉;②先加$\mathrm{Zn}$粉、后加盐酸,得到固体为红棕色,则一定有$\mathrm{Cu}$($\mathrm{Cu_2O}$和$\mathrm{HCl}$发生歧化反应生成$\mathrm{Cu}$),$20\mathrm{mL}\ 0.5\mathrm{mol· L^{-1}}\ \mathrm{CuSO_4}$中$n(\mathrm{Cu^{2+}})=0.5\mathrm{mol· L^{-1}}×20\mathrm{mL}×10^{-3}\mathrm{L· mL^{-1}}=0.01\mathrm{mol}$,$\mathrm{Cu}$的最大物质的量为$0.01\mathrm{mol}$,质量为$0.64\mathrm{g}$,生成$\mathrm{Cu_2O}$的最大质量为$0.72\mathrm{g}$,实际固体质量为$0.78\mathrm{g}$。若只有$\mathrm{Cu}$,则固体质量应小于等于$0.64\mathrm{g}$,a错误;若是$\mathrm{Cu}$包裹$\mathrm{Zn}$,则$0.64\mathrm{g}<$固体质量$<1.18\mathrm{g}$,b正确;若是$\mathrm{CuO}$,则不可能为红棕色,c错误;若是$\mathrm{Cu}$和$\mathrm{Cu_2O}$,固体质量应介于$0.64\sim0.72\mathrm{g}$之间,d错误;③实验1得到的溶液呈无色,说明一定无$\mathrm{CuO}$,那么X的组成只能是$\mathrm{Cu}$;从物质形态角度分析,X为黑色的原因是金属$\mathrm{Cu}$呈粉末状时,光线进入后被多次反射吸收,所以呈黑色。
经典真题1
(1)①$\mathrm{Cu_2O}$还原②$\mathrm{Cu(OH)_2\xlongequal{\triangle}CuO + H_2O}$
(2)①除去过量的锌粉②b③Ⅲ 光线进入后被多次反射吸收,所以呈黑色
解题思路

得到的溶液呈无色,说明一定无$\mathrm{CuO}$,那么X的组成只能是$\mathrm{Cu}$
实验1
1)足量稀$\mathrm{H_2SO_4}$ 2)足量$\mathrm{NH_3· H_2O}$
无色溶液+黑色粉末
实验2
足量$\mathrm{HNO_3}$
蓝色溶液
$\mathrm{Cu}$和稀$\mathrm{HNO_3}$反应生成蓝色的$\mathrm{Cu(NO_3)_2}$溶液:
$3\mathrm{Cu}+8\mathrm{HNO_3}=3\mathrm{Cu(NO_3)_2}+2\mathrm{NO}\uparrow+4\mathrm{H_2O}$
解析:
(1)①新制氢氧化铜悬浊液与葡萄糖中的醛基反应产生的砖红色沉淀为$\mathrm{Cu_2O}$,$\mathrm{Cu}$被葡萄糖从 +2 价还原为 +1 价,葡萄糖表现出还原性;②生成的黑色沉淀为$\mathrm{CuO}$,反应的化学方程式为$\mathrm{Cu(OH)_2\xlongequal{\triangle}CuO + H_2O}$。
(2)①由题干加入盐酸并加热至溶液中无气泡产生为止可知,加入盐酸的作用是除去过量的锌粉;②先加$\mathrm{Zn}$粉、后加盐酸,得到固体为红棕色,则一定有$\mathrm{Cu}$($\mathrm{Cu_2O}$和$\mathrm{HCl}$发生歧化反应生成$\mathrm{Cu}$),$20\mathrm{mL}\ 0.5\mathrm{mol· L^{-1}}\ \mathrm{CuSO_4}$中$n(\mathrm{Cu^{2+}})=0.5\mathrm{mol· L^{-1}}×20\mathrm{mL}×10^{-3}\mathrm{L· mL^{-1}}=0.01\mathrm{mol}$,$\mathrm{Cu}$的最大物质的量为$0.01\mathrm{mol}$,质量为$0.64\mathrm{g}$,生成$\mathrm{Cu_2O}$的最大质量为$0.72\mathrm{g}$,实际固体质量为$0.78\mathrm{g}$。若只有$\mathrm{Cu}$,则固体质量应小于等于$0.64\mathrm{g}$,a错误;若是$\mathrm{Cu}$包裹$\mathrm{Zn}$,则$0.64\mathrm{g}<$固体质量$<1.18\mathrm{g}$,b正确;若是$\mathrm{CuO}$,则不可能为红棕色,c错误;若是$\mathrm{Cu}$和$\mathrm{Cu_2O}$,固体质量应介于$0.64\sim0.72\mathrm{g}$之间,d错误;③实验1得到的溶液呈无色,说明一定无$\mathrm{CuO}$,那么X的组成只能是$\mathrm{Cu}$;从物质形态角度分析,X为黑色的原因是金属$\mathrm{Cu}$呈粉末状时,光线进入后被多次反射吸收,所以呈黑色。
经典真题2 滴定法/测量气体质量法
(2025·安徽,16,14分)侯氏制碱法以NaCl、CO₂和NH₃为反应物制备纯碱。某实验小组在侯氏制碱法基础上,以NaCl和NH₄HCO₃为反应物,在实验室制备纯碱,步骤如下:
①配制饱和食盐水;
②在水浴加热下,将一定量研细的NH₄HCO₃加入饱和食盐水中,搅拌,使NH₄HCO₃溶解,静置,析出NaHCO₃晶体;
③将NaHCO₃晶体减压过滤、煅烧,得到Na₂CO₃固体。
回答下列问题:
(1)步骤①中配制饱和食盐水,下列仪器中需要使用的有
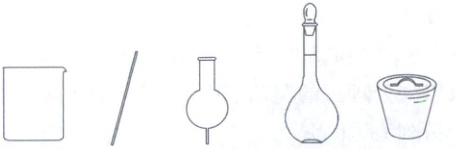
(2)步骤②中NH₄HCO₃需研细后加入,目的是
(3)在实验室使用NH₄HCO₃代替CO₂和NH₃制备纯碱,优点是
(4)实验小组使用滴定法测定了产品的成分。滴定过程中溶液的pH随滴加盐酸体积变化的曲线如图所示。
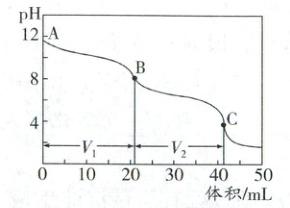
①到达第一个滴定终点B时消耗盐酸V₁mL,到达第二个滴定终点C时又消耗盐酸V₂mL。V₁=V₂,所得产品的成分为
a.Na₂CO₃
b.NaHCO₃
c.Na₂CO₃和NaHCO₃
d.Na₂CO₃和NaOH
②到达第一个滴定终点前,某同学滴定速度过快,摇动锥形瓶不均匀,致使滴入盐酸局部过浓。该同学所记录的V₁'
(5)已知常温下Na₂CO₃和NaHCO₃的溶解度分别为30.7g和10.3g。向饱和Na₂CO₃溶液中持续通入CO₂气体会产生NaHCO₃晶体。实验小组进行相应探究:

①实验a无明显现象的原因是
②析出的白色晶体可能同时含有NaHCO₃和Na₂CO₃·10H₂O。称取0.42g晾干后的白色晶体,加热至恒重,将产生的气体依次通过足量的无水CaCl₂和NaOH溶液,NaOH溶液增重0.088g,则白色晶体中NaHCO₃的质量分数为
(2025·安徽,16,14分)侯氏制碱法以NaCl、CO₂和NH₃为反应物制备纯碱。某实验小组在侯氏制碱法基础上,以NaCl和NH₄HCO₃为反应物,在实验室制备纯碱,步骤如下:
①配制饱和食盐水;
②在水浴加热下,将一定量研细的NH₄HCO₃加入饱和食盐水中,搅拌,使NH₄HCO₃溶解,静置,析出NaHCO₃晶体;
③将NaHCO₃晶体减压过滤、煅烧,得到Na₂CO₃固体。
回答下列问题:
(1)步骤①中配制饱和食盐水,下列仪器中需要使用的有
烧杯、玻璃棒
(填名称)。
(2)步骤②中NH₄HCO₃需研细后加入,目的是
加快$\mathrm{NH_4HCO_3}$溶解、加快$\mathrm{NH_4HCO_3}$与$\mathrm{NaCl}$反应
。(3)在实验室使用NH₄HCO₃代替CO₂和NH₃制备纯碱,优点是
工艺简单、绿色环保、制备产品的效率较高、原料利用率较高
。(4)实验小组使用滴定法测定了产品的成分。滴定过程中溶液的pH随滴加盐酸体积变化的曲线如图所示。

①到达第一个滴定终点B时消耗盐酸V₁mL,到达第二个滴定终点C时又消耗盐酸V₂mL。V₁=V₂,所得产品的成分为
a
(填字母)。a.Na₂CO₃
b.NaHCO₃
c.Na₂CO₃和NaHCO₃
d.Na₂CO₃和NaOH
②到达第一个滴定终点前,某同学滴定速度过快,摇动锥形瓶不均匀,致使滴入盐酸局部过浓。该同学所记录的V₁'
>
V₁(填“>”“<”或“=”)。(5)已知常温下Na₂CO₃和NaHCO₃的溶解度分别为30.7g和10.3g。向饱和Na₂CO₃溶液中持续通入CO₂气体会产生NaHCO₃晶体。实验小组进行相应探究:

①实验a无明显现象的原因是
$\mathrm{CO_2}$在饱和$\mathrm{Na_2CO_3}$溶液中的溶解速率小、溶解量小,且两者发生反应的速率也较小,生成的$\mathrm{NaHCO_3}$的量较少,$\mathrm{NaHCO_3}$在该溶液中没有达到过饱和状态,故不能析出晶体
。②析出的白色晶体可能同时含有NaHCO₃和Na₂CO₃·10H₂O。称取0.42g晾干后的白色晶体,加热至恒重,将产生的气体依次通过足量的无水CaCl₂和NaOH溶液,NaOH溶液增重0.088g,则白色晶体中NaHCO₃的质量分数为
80%
。
答案:
经典真题2
(1)烧杯、玻璃棒
(2)加快$\mathrm{NH_4HCO_3}$溶解、加快$\mathrm{NH_4HCO_3}$与$\mathrm{NaCl}$反应
(3)工艺简单、绿色环保、制备产品的效率较高、原料利用率较高
(4)①a②>
(5)①$\mathrm{CO_2}$在饱和$\mathrm{Na_2CO_3}$溶液中的溶解速率小、溶解量小,且两者发生反应的速率也较小,生成的$\mathrm{NaHCO_3}$的量较少,$\mathrm{NaHCO_3}$在该溶液中没有达到过饱和状态,故不能析出晶体②80%
解题思路
实验目的:探究$\mathrm{CO_2}$与饱和$\mathrm{Na_2CO_3}$溶液反应产生的晶体成分
实验 操作 现象 实验原理
a 将$\mathrm{CO_2}$匀速通入置于烧杯中的$20\mathrm{mL}$饱和$\mathrm{Na_2CO_3}$溶液,持续$20\mathrm{min}$,消耗$600\mathrm{mL}\ \mathrm{CO_2}$ 无明显现象 $\mathrm{CO_2}$在饱和$\mathrm{Na_2CO_3}$溶液中的溶解量小,且两者发生反应的速率也较小,生成的$\mathrm{NaHCO_3}$的量较少,$\mathrm{NaHCO_3}$在该溶液中没有达到过饱和状态,故不能析出晶体
b 将$20\mathrm{mL}$饱和$\mathrm{Na_2CO_3}$溶液注入充满$\mathrm{CO_2}$的$500\mathrm{mL}$矿泉水瓶中,密闭,剧烈摇动矿泉水瓶$1\sim2\mathrm{min}$,静置 矿泉水瓶变瘪,$3\mathrm{min}$后开始有白色晶体析出 增大了$\mathrm{CO_2}$和饱和$\mathrm{Na_2CO_3}$溶液发生反应的速率,发生反应$\mathrm{Na_2CO_3}+\mathrm{CO_2}+\mathrm{H_2O}=2\mathrm{NaHCO_3}\downarrow$
解析:
(1)步骤①中配制饱和食盐水,要在烧杯中放入一定量的食盐,然后向其中加入适量的水并用玻璃棒搅拌使其恰好溶解,因此需要使用的有烧杯和玻璃棒。
(2)固体的颗粒越小,其溶解速率越大,且与其他物质反应的速率越大。
(3)$\mathrm{CO_2}$和$\mathrm{NH_3}$在水中可以发生反应生成$\mathrm{NH_4HCO_3}$,但是存在气体不能完全溶解、气体的利用率低且对环境会产生不好的影响等问题。
(4)①根据图中的曲线变化可知,到达第一个滴定终点B时,发生的反应为$\mathrm{Na_2CO_3}+\mathrm{HCl}=\mathrm{NaCl}+\mathrm{NaHCO_3}$,消耗盐酸$V_1\mathrm{mL}$;到达第二个滴定终点C时,发生的反应为$\mathrm{NaHCO_3}+\mathrm{HCl}=\mathrm{NaCl}+\mathrm{CO_2}\uparrow+\mathrm{H_2O}$,又消耗盐酸$V_2\mathrm{mL}$,因为$V_1=V_2$,说明产品中不含$\mathrm{NaHCO_3}$和$\mathrm{NaOH}$,因此,所得产品的成分为$\mathrm{Na_2CO_3}$,a正确;②滴入盐酸局部过浓,其必然会使一部分$\mathrm{Na_2CO_3}$与盐酸反应生成$\mathrm{CO_2}$,从而使得$V_1>V_1'$。
(5)②$\mathrm{NaHCO_3}$受热分解生成的气体中有$\mathrm{H_2O}$和$\mathrm{CO_2}$,而$\mathrm{Na_2CO_3}·10\mathrm{H_2O}$分解产生的气体中只有$\mathrm{H_2O}$,无水$\mathrm{CaCl_2}$可以吸收分解产生的$\mathrm{H_2O}$,$\mathrm{NaOH}$溶液可以吸收分解产生的$\mathrm{CO_2}$;$\mathrm{NaOH}$溶液增重$0.088\mathrm{g}$,则分解产生的$\mathrm{CO_2}$的质量为$0.088\mathrm{g}$,其物质的量为$\frac{0.088\mathrm{g}}{44\mathrm{g· mol^{-1}}}=0.002\mathrm{mol}$,由分解反应可知,$\mathrm{NaHCO_3}$的物质的量为$0.004\mathrm{mol}$,则白色晶体中$\mathrm{NaHCO_3}$的质量为$0.004\mathrm{mol}×84\mathrm{g· mol^{-1}}=0.336\mathrm{g}$,故其质量分数为$\frac{0.336\mathrm{g}}{0.42\mathrm{g}}×100\%=80\%$。
(1)烧杯、玻璃棒
(2)加快$\mathrm{NH_4HCO_3}$溶解、加快$\mathrm{NH_4HCO_3}$与$\mathrm{NaCl}$反应
(3)工艺简单、绿色环保、制备产品的效率较高、原料利用率较高
(4)①a②>
(5)①$\mathrm{CO_2}$在饱和$\mathrm{Na_2CO_3}$溶液中的溶解速率小、溶解量小,且两者发生反应的速率也较小,生成的$\mathrm{NaHCO_3}$的量较少,$\mathrm{NaHCO_3}$在该溶液中没有达到过饱和状态,故不能析出晶体②80%
解题思路
实验目的:探究$\mathrm{CO_2}$与饱和$\mathrm{Na_2CO_3}$溶液反应产生的晶体成分
实验 操作 现象 实验原理
a 将$\mathrm{CO_2}$匀速通入置于烧杯中的$20\mathrm{mL}$饱和$\mathrm{Na_2CO_3}$溶液,持续$20\mathrm{min}$,消耗$600\mathrm{mL}\ \mathrm{CO_2}$ 无明显现象 $\mathrm{CO_2}$在饱和$\mathrm{Na_2CO_3}$溶液中的溶解量小,且两者发生反应的速率也较小,生成的$\mathrm{NaHCO_3}$的量较少,$\mathrm{NaHCO_3}$在该溶液中没有达到过饱和状态,故不能析出晶体
b 将$20\mathrm{mL}$饱和$\mathrm{Na_2CO_3}$溶液注入充满$\mathrm{CO_2}$的$500\mathrm{mL}$矿泉水瓶中,密闭,剧烈摇动矿泉水瓶$1\sim2\mathrm{min}$,静置 矿泉水瓶变瘪,$3\mathrm{min}$后开始有白色晶体析出 增大了$\mathrm{CO_2}$和饱和$\mathrm{Na_2CO_3}$溶液发生反应的速率,发生反应$\mathrm{Na_2CO_3}+\mathrm{CO_2}+\mathrm{H_2O}=2\mathrm{NaHCO_3}\downarrow$
解析:
(1)步骤①中配制饱和食盐水,要在烧杯中放入一定量的食盐,然后向其中加入适量的水并用玻璃棒搅拌使其恰好溶解,因此需要使用的有烧杯和玻璃棒。
(2)固体的颗粒越小,其溶解速率越大,且与其他物质反应的速率越大。
(3)$\mathrm{CO_2}$和$\mathrm{NH_3}$在水中可以发生反应生成$\mathrm{NH_4HCO_3}$,但是存在气体不能完全溶解、气体的利用率低且对环境会产生不好的影响等问题。
(4)①根据图中的曲线变化可知,到达第一个滴定终点B时,发生的反应为$\mathrm{Na_2CO_3}+\mathrm{HCl}=\mathrm{NaCl}+\mathrm{NaHCO_3}$,消耗盐酸$V_1\mathrm{mL}$;到达第二个滴定终点C时,发生的反应为$\mathrm{NaHCO_3}+\mathrm{HCl}=\mathrm{NaCl}+\mathrm{CO_2}\uparrow+\mathrm{H_2O}$,又消耗盐酸$V_2\mathrm{mL}$,因为$V_1=V_2$,说明产品中不含$\mathrm{NaHCO_3}$和$\mathrm{NaOH}$,因此,所得产品的成分为$\mathrm{Na_2CO_3}$,a正确;②滴入盐酸局部过浓,其必然会使一部分$\mathrm{Na_2CO_3}$与盐酸反应生成$\mathrm{CO_2}$,从而使得$V_1>V_1'$。
(5)②$\mathrm{NaHCO_3}$受热分解生成的气体中有$\mathrm{H_2O}$和$\mathrm{CO_2}$,而$\mathrm{Na_2CO_3}·10\mathrm{H_2O}$分解产生的气体中只有$\mathrm{H_2O}$,无水$\mathrm{CaCl_2}$可以吸收分解产生的$\mathrm{H_2O}$,$\mathrm{NaOH}$溶液可以吸收分解产生的$\mathrm{CO_2}$;$\mathrm{NaOH}$溶液增重$0.088\mathrm{g}$,则分解产生的$\mathrm{CO_2}$的质量为$0.088\mathrm{g}$,其物质的量为$\frac{0.088\mathrm{g}}{44\mathrm{g· mol^{-1}}}=0.002\mathrm{mol}$,由分解反应可知,$\mathrm{NaHCO_3}$的物质的量为$0.004\mathrm{mol}$,则白色晶体中$\mathrm{NaHCO_3}$的质量为$0.004\mathrm{mol}×84\mathrm{g· mol^{-1}}=0.336\mathrm{g}$,故其质量分数为$\frac{0.336\mathrm{g}}{0.42\mathrm{g}}×100\%=80\%$。
查看更多完整答案,请扫码查看


