2025年学霸高考黑题化学人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年学霸高考黑题化学人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第116页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
经典真题1 (考查晶胞投影型) (2025·山东,16,12分) Fe单质及其化合物应用广泛。回答下列问题:
(1)在元素周期表中,Fe位于第
(2)尿素分子(H₂NCONH₂)与Fe³⁺形成配离子的硝酸盐[Fe(H₂NCONH₂)₆](NO₃)₃俗称尿素铁,既可作铁肥,又可作缓释氮肥。
①元素C、N、O中,第一电离能最大的是
②尿素分子中,C原子采取的轨道杂化方式为
③八面体配离子[Fe(H₂NCONH₂)₆]³⁺中Fe³⁺的配位数为6,碳氮键的键长均相等,则与Fe³⁺配位的原子是
(3)α-Fe可用作合成氨催化剂,其体心立方晶胞如图所示(晶胞边长为$a$ pm)。
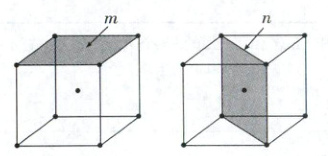
①α-Fe晶胞中Fe原子的半径为
②研究发现,α-Fe晶胞中阴影所示$m$、$n$两个截面的催化活性不同,截面单位面积含有Fe原子个数越多,催化活性越低。$m$、$n$截面中,催化活性较低的是
(1)在元素周期表中,Fe位于第
四
周期Ⅷ
族。基态Fe原子与基态Fe³⁺未成对电子数之比为4∶5
。(2)尿素分子(H₂NCONH₂)与Fe³⁺形成配离子的硝酸盐[Fe(H₂NCONH₂)₆](NO₃)₃俗称尿素铁,既可作铁肥,又可作缓释氮肥。
①元素C、N、O中,第一电离能最大的是
N
,电负性最大的是O
。②尿素分子中,C原子采取的轨道杂化方式为
sp²
。③八面体配离子[Fe(H₂NCONH₂)₆]³⁺中Fe³⁺的配位数为6,碳氮键的键长均相等,则与Fe³⁺配位的原子是
O
(填元素符号)。(3)α-Fe可用作合成氨催化剂,其体心立方晶胞如图所示(晶胞边长为$a$ pm)。

①α-Fe晶胞中Fe原子的半径为
$\frac{\sqrt{3}a}{4}$
pm。②研究发现,α-Fe晶胞中阴影所示$m$、$n$两个截面的催化活性不同,截面单位面积含有Fe原子个数越多,催化活性越低。$m$、$n$截面中,催化活性较低的是
n
,该截面单位面积含有的Fe原子为$\frac{\sqrt{2}}{a^2}$
个·pm⁻²。
答案:
经典真题1
(1)四 Ⅷ 4∶5
(2)①N O ②sp² ③O
(3)①$\frac{\sqrt{3}a}{4}$ ②n $\frac{\sqrt{2}}{a^2}$
解析:
(1)Fe为26号元素,位于元素周期表中第四周期Ⅷ族;基态Fe原子电子排布式为[Ar]3d⁶4s²,未成对电子数为4,基态Fe³⁺电子排布式为[Ar]3d⁵,未成对电子数为5。
(2)①同周期元素从左到右,第一电离能呈增大趋势,但N原子2p轨道为半充满稳定结构,第一电离能:N>O>C;同周期元素从左到右,电负性逐渐增大,因此电负性:O>N>C。②尿素分子(H₂NCONH₂)中C原子形成3个σ键,无孤电子对,采取的轨道杂化方式为sp²杂化。③八面体配离子[Fe(H₂NCONH₂)₆]³⁺中Fe³⁺的配位数为6,碳氮键的键长均相等,因此N原子不会参与形成配位键,说明C=O中O原子参与配位,所以与Fe³⁺配位的原子是O。
(3)①α - Fe为体心立方晶胞,晶胞边长为a pm,体对角线长度为$\sqrt{3}a$ pm,体心立方晶胞中Fe原子半径r与体对角线关系为4r = $\sqrt{3}a$,因此Fe原子的半径为$\frac{\sqrt{3}a}{4}$pm。②m截面积Sₘ = a² pm²,每个角原子被4个相邻晶胞共享(二维共享),如图所示: ,每个晶胞的顶点原子贡献$\frac{1}{4}$个原子给该晶面,所含原子数为4×$\frac{1}{4}$ = 1,单位面积原子数为$\frac{1}{a^2}$个·pm⁻²,n截面积为a×$\sqrt{2}a$ = $\sqrt{2}a^2$ pm²,每个角原子被4个相邻晶胞共享,体心原子完全属于本截面,所含原子数为(4×$\frac{1}{4}$ + 1)=2,单位面积原子数为$\frac{2}{\sqrt{2}a^2}$ = $\frac{\sqrt{2}}{a^2}$个·pm⁻²,因此催化活性较低的是n截面,该截面单位面积含有的Fe原子为$\frac{\sqrt{2}}{a^2}$个·pm⁻²。
,每个晶胞的顶点原子贡献$\frac{1}{4}$个原子给该晶面,所含原子数为4×$\frac{1}{4}$ = 1,单位面积原子数为$\frac{1}{a^2}$个·pm⁻²,n截面积为a×$\sqrt{2}a$ = $\sqrt{2}a^2$ pm²,每个角原子被4个相邻晶胞共享,体心原子完全属于本截面,所含原子数为(4×$\frac{1}{4}$ + 1)=2,单位面积原子数为$\frac{2}{\sqrt{2}a^2}$ = $\frac{\sqrt{2}}{a^2}$个·pm⁻²,因此催化活性较低的是n截面,该截面单位面积含有的Fe原子为$\frac{\sqrt{2}}{a^2}$个·pm⁻²。
经典真题1
(1)四 Ⅷ 4∶5
(2)①N O ②sp² ③O
(3)①$\frac{\sqrt{3}a}{4}$ ②n $\frac{\sqrt{2}}{a^2}$
解析:
(1)Fe为26号元素,位于元素周期表中第四周期Ⅷ族;基态Fe原子电子排布式为[Ar]3d⁶4s²,未成对电子数为4,基态Fe³⁺电子排布式为[Ar]3d⁵,未成对电子数为5。
(2)①同周期元素从左到右,第一电离能呈增大趋势,但N原子2p轨道为半充满稳定结构,第一电离能:N>O>C;同周期元素从左到右,电负性逐渐增大,因此电负性:O>N>C。②尿素分子(H₂NCONH₂)中C原子形成3个σ键,无孤电子对,采取的轨道杂化方式为sp²杂化。③八面体配离子[Fe(H₂NCONH₂)₆]³⁺中Fe³⁺的配位数为6,碳氮键的键长均相等,因此N原子不会参与形成配位键,说明C=O中O原子参与配位,所以与Fe³⁺配位的原子是O。
(3)①α - Fe为体心立方晶胞,晶胞边长为a pm,体对角线长度为$\sqrt{3}a$ pm,体心立方晶胞中Fe原子半径r与体对角线关系为4r = $\sqrt{3}a$,因此Fe原子的半径为$\frac{\sqrt{3}a}{4}$pm。②m截面积Sₘ = a² pm²,每个角原子被4个相邻晶胞共享(二维共享),如图所示:
 ,每个晶胞的顶点原子贡献$\frac{1}{4}$个原子给该晶面,所含原子数为4×$\frac{1}{4}$ = 1,单位面积原子数为$\frac{1}{a^2}$个·pm⁻²,n截面积为a×$\sqrt{2}a$ = $\sqrt{2}a^2$ pm²,每个角原子被4个相邻晶胞共享,体心原子完全属于本截面,所含原子数为(4×$\frac{1}{4}$ + 1)=2,单位面积原子数为$\frac{2}{\sqrt{2}a^2}$ = $\frac{\sqrt{2}}{a^2}$个·pm⁻²,因此催化活性较低的是n截面,该截面单位面积含有的Fe原子为$\frac{\sqrt{2}}{a^2}$个·pm⁻²。
,每个晶胞的顶点原子贡献$\frac{1}{4}$个原子给该晶面,所含原子数为4×$\frac{1}{4}$ = 1,单位面积原子数为$\frac{1}{a^2}$个·pm⁻²,n截面积为a×$\sqrt{2}a$ = $\sqrt{2}a^2$ pm²,每个角原子被4个相邻晶胞共享,体心原子完全属于本截面,所含原子数为(4×$\frac{1}{4}$ + 1)=2,单位面积原子数为$\frac{2}{\sqrt{2}a^2}$ = $\frac{\sqrt{2}}{a^2}$个·pm⁻²,因此催化活性较低的是n截面,该截面单位面积含有的Fe原子为$\frac{\sqrt{2}}{a^2}$个·pm⁻²。 经典真题2 (只含晶胞参数计算型) (2024·全国甲,35,15分) ⅣA族元素具有丰富的化学性质,其化合物有着广泛的应用。回答下列问题:
(1)该族元素基态原子核外未成对电子数为
(2)CaC₂俗称电石,该化合物中不存在的化学键类型为
a. 离子键
b. 极性共价键
c. 非极性共价键
d. 配位键
(3)一种光刻胶薄膜成分为聚甲基硅烷$\begin{bmatrix} \overset {CH_{3}}{Si}\\ H\end{bmatrix} _{n}$,其中电负性最大的元素是
(4)早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如表所示,结合变化规律说明原因:

(5)结晶型PbS可作为放射性探测器元件材料,其立方晶胞如图所示。其中Pb的配位数为

(1)该族元素基态原子核外未成对电子数为
2
,在与其他元素形成化合物时,呈现的最高化合价为+4
。(2)CaC₂俗称电石,该化合物中不存在的化学键类型为
bd
(填字母)。a. 离子键
b. 极性共价键
c. 非极性共价键
d. 配位键
(3)一种光刻胶薄膜成分为聚甲基硅烷$\begin{bmatrix} \overset {CH_{3}}{Si}\\ H\end{bmatrix} _{n}$,其中电负性最大的元素是
C
,硅原子的杂化轨道类型为sp³
。(4)早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如表所示,结合变化规律说明原因:
SnF₄属于离子晶体,SnCl₄、SnBr₄、SnI₄属于分子晶体,离子晶体的熔点比分子晶体的高,分子晶体的相对分子质量越大,分子间作用力越强,熔点越高
。
(5)结晶型PbS可作为放射性探测器元件材料,其立方晶胞如图所示。其中Pb的配位数为
6
。设$N_{A}$为阿伏加德罗常数的值,则该晶体密度为$\frac{4×(207 + 32)}{N_A×(594×10^{-10})^3}$或$\frac{956}{N_A×(594×10^{-10})^3}$
g·cm⁻³(列出计算式)。
答案:
经典真题2
(1)2 +4
(2)bd
(3)C sp³
(4)SnF₄属于离子晶体,SnCl₄、SnBr₄、SnI₄属于分子晶体,离子晶体的熔点比分子晶体的高,分子晶体的相对分子质量越大,分子间作用力越强,熔点越高
(5)6 $\frac{4×(207 + 32)}{N_A×(594×10^{-10})^3}$或$\frac{956}{N_A×(594×10^{-10})^3}$
解析:
(1)ⅣA族元素基态原子的价层电子排布式为ns²np²,其核外未成对电子数为2,因最外层电子数均为4,所以在与其他元素形成化合物时,呈现的最高化合价为+4。
(2)CaC₂俗称电石,由Ca²⁺和C₂²⁻构成,两种离子间存在离子键,C₂²⁻中两个C原子之间存在非极性共价键。
(3)聚甲基硅烷[$\underset{\overset{\vert}{CH_3}}{Si}$]ₙ含C、Si、H三种元素,其电负性大小:C>H>Si,硅原子与周围的4个原子形成共价键,没有孤电子对,价层电子对数为4,则硅原子的杂化轨道类型为sp³。
(4)根据表中数据可知,SnF₄的熔点均远高于其余三种物质,因为SnF₄属于离子晶体,SnCl₄、SnBr₄、SnI₄属于分子晶体,离子晶体的熔点比分子晶体的高,SnCl₄、SnBr₄、SnI₄三种物质的相对分子质量依次增大,分子间作用力依次增强,熔点升高。
(5)由PbS晶胞结构图可知,该晶胞中有4个Pb和4个S,距离每个原子周围最近的原子数均为6,因此Pb的配位数为6。设N_A为阿伏加德罗常数的值,则N_A个晶胞的质量为4×(207 + 32)g,N_A个晶胞的体积为N_A×(594×10⁻¹⁰)³ cm³,因此该晶体密度为$\frac{4×(207 + 32)}{N_A×(594×10^{-10})^3}$g·cm⁻³或$\frac{956}{N_A×(594×10^{-10})^3}$g·cm⁻³。
(1)2 +4
(2)bd
(3)C sp³
(4)SnF₄属于离子晶体,SnCl₄、SnBr₄、SnI₄属于分子晶体,离子晶体的熔点比分子晶体的高,分子晶体的相对分子质量越大,分子间作用力越强,熔点越高
(5)6 $\frac{4×(207 + 32)}{N_A×(594×10^{-10})^3}$或$\frac{956}{N_A×(594×10^{-10})^3}$
解析:
(1)ⅣA族元素基态原子的价层电子排布式为ns²np²,其核外未成对电子数为2,因最外层电子数均为4,所以在与其他元素形成化合物时,呈现的最高化合价为+4。
(2)CaC₂俗称电石,由Ca²⁺和C₂²⁻构成,两种离子间存在离子键,C₂²⁻中两个C原子之间存在非极性共价键。
(3)聚甲基硅烷[$\underset{\overset{\vert}{CH_3}}{Si}$]ₙ含C、Si、H三种元素,其电负性大小:C>H>Si,硅原子与周围的4个原子形成共价键,没有孤电子对,价层电子对数为4,则硅原子的杂化轨道类型为sp³。
(4)根据表中数据可知,SnF₄的熔点均远高于其余三种物质,因为SnF₄属于离子晶体,SnCl₄、SnBr₄、SnI₄属于分子晶体,离子晶体的熔点比分子晶体的高,SnCl₄、SnBr₄、SnI₄三种物质的相对分子质量依次增大,分子间作用力依次增强,熔点升高。
(5)由PbS晶胞结构图可知,该晶胞中有4个Pb和4个S,距离每个原子周围最近的原子数均为6,因此Pb的配位数为6。设N_A为阿伏加德罗常数的值,则N_A个晶胞的质量为4×(207 + 32)g,N_A个晶胞的体积为N_A×(594×10⁻¹⁰)³ cm³,因此该晶体密度为$\frac{4×(207 + 32)}{N_A×(594×10^{-10})^3}$g·cm⁻³或$\frac{956}{N_A×(594×10^{-10})^3}$g·cm⁻³。
查看更多完整答案,请扫码查看


