2025年学霸高考黑题化学人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年学霸高考黑题化学人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第119页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
巩固训练3 (2025·江苏无锡模拟) 硼烷-四氢呋喃(BH₃·THF,结构简式为 )是一种硼氢化和还原性的试剂,易溶于四氢呋喃
)是一种硼氢化和还原性的试剂,易溶于四氢呋喃 ,遇水剧烈反应放出氢气。工业上常用于有机物中某些官能团的硼氢化和还原化。请回答下列问题:
,遇水剧烈反应放出氢气。工业上常用于有机物中某些官能团的硼氢化和还原化。请回答下列问题:
(1)BH₃·THF组成元素的电负性由大到小的顺序为
A. 1s²2s²2p¹
B. 1s²2s²
C. 1s²2s¹2p¹
D. 1s²2p²
(2)先将NaBH₄和BF₃溶于二乙二醇二甲醚(CH₃OCH₂CH₂OCH₂CH₂OCH₃)中,充分溶解,再加入四氢呋喃,反应30 min,经分离提纯即得较纯净的BH₃·THF,同时还有另一种产物NaF。
①制备BH₃·THF的化学方程式为
②制备过程中,BF₃中B的杂化方式的变化是
③二乙二醇二甲醚在水中的溶解度大于在苯中的溶解度,其原因是
(3)硼氢化钠在室温下是α型的立方晶体(如图甲所示),6.3 GPa下转变为四方晶体(如图乙所示)。
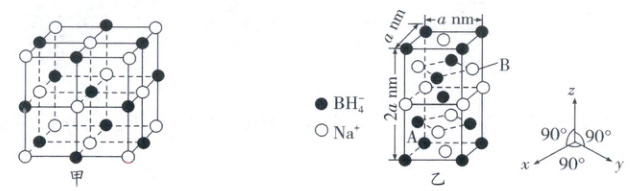
①硼氢化钠的α型立方晶体中,离BH₄⁻最近的BH₄⁻有
②硼氢化钠的四方晶体中,晶胞中A、B间距离$d$ =
 )是一种硼氢化和还原性的试剂,易溶于四氢呋喃
)是一种硼氢化和还原性的试剂,易溶于四氢呋喃 ,遇水剧烈反应放出氢气。工业上常用于有机物中某些官能团的硼氢化和还原化。请回答下列问题:
,遇水剧烈反应放出氢气。工业上常用于有机物中某些官能团的硼氢化和还原化。请回答下列问题:(1)BH₃·THF组成元素的电负性由大到小的顺序为
O>C>H>B
(用元素符号表示)。下列状态的硼中,电离最外层一个电子所需能量最大的是B
(填字母)。A. 1s²2s²2p¹
B. 1s²2s²
C. 1s²2s¹2p¹
D. 1s²2p²
(2)先将NaBH₄和BF₃溶于二乙二醇二甲醚(CH₃OCH₂CH₂OCH₂CH₂OCH₃)中,充分溶解,再加入四氢呋喃,反应30 min,经分离提纯即得较纯净的BH₃·THF,同时还有另一种产物NaF。
①制备BH₃·THF的化学方程式为
4 + 3NaBH₄ + BF₃ = 4
+ 3NaBH₄ + BF₃ = 4 BH₃ + 3NaF
BH₃ + 3NaF
。 + 3NaBH₄ + BF₃ = 4
+ 3NaBH₄ + BF₃ = 4 BH₃ + 3NaF
BH₃ + 3NaF②制备过程中,BF₃中B的杂化方式的变化是
sp²→sp³
,上述物质中含配位键的是NaBH₄、BH₃·THF
。③二乙二醇二甲醚在水中的溶解度大于在苯中的溶解度,其原因是
二乙二醇二甲醚和水都是极性分子,同时二乙二醇二甲醚能与水分子形成氢键
。(3)硼氢化钠在室温下是α型的立方晶体(如图甲所示),6.3 GPa下转变为四方晶体(如图乙所示)。

①硼氢化钠的α型立方晶体中,离BH₄⁻最近的BH₄⁻有
12
个。②硼氢化钠的四方晶体中,晶胞中A、B间距离$d$ =
$\frac{\sqrt{14}}{2}a$
nm(用含$a$的代数式表示)。
答案:
巩固训练3
(1)O>C>H>B B
(2)①4 + 3NaBH₄ + BF₃ = 4
+ 3NaBH₄ + BF₃ = 4 BH₃ + 3NaF ②sp²→sp³ NaBH₄、BH₃·THF ③二乙二醇二甲醚和水都是极性分子,同时二乙二醇二甲醚能与水分子形成氢键
BH₃ + 3NaF ②sp²→sp³ NaBH₄、BH₃·THF ③二乙二醇二甲醚和水都是极性分子,同时二乙二醇二甲醚能与水分子形成氢键
(3)①12 ②$\frac{\sqrt{14}}{2}a$
解析:
(1)BH₃·THF中组成元素为H、C、O、B,该物质为还原性物质,遇水放出氢气,推断出BH₃中H显负价,即H的电负性强于B,同周期从左向右电负性增大,四种元素电负性由大到小顺序是O>C>H>B;1s²2s²2p¹是基态B原子,能量低;1s²2s¹2p¹是B激发态,能量高;1s²2p²是B激发态,能量高;综上所述,失去一个电子所需能量最大的是1s²2s²。
(2)①根据题意,制备BH₃·THF的化学方程式为4 + 3NaBH₄ + BF₃ = 4
+ 3NaBH₄ + BF₃ = 4 BH₃ + 3NaF;②BF₃中B的价层电子对数为$\frac{3 + 3×1}{2}$ = 3,杂化类型为sp²,依据硼烷 - 四氢呋喃的结构简式,推出B的杂化类型为sp³,即制备过程中B的杂化方式变化为sp²→sp³,BH₃中B形成三个σ键,B还有一个空轨道,能容纳孤电子对,形成配位键,因此含配位键的是NaBH₄、
BH₃ + 3NaF;②BF₃中B的价层电子对数为$\frac{3 + 3×1}{2}$ = 3,杂化类型为sp²,依据硼烷 - 四氢呋喃的结构简式,推出B的杂化类型为sp³,即制备过程中B的杂化方式变化为sp²→sp³,BH₃中B形成三个σ键,B还有一个空轨道,能容纳孤电子对,形成配位键,因此含配位键的是NaBH₄、 BH₃或BH₃·THF;③二乙二醇二甲醚、水属于极性分子,苯为非极性分子,根据“相似相溶”原理,二乙二醇二甲醚在水中的溶解度大于在苯中的溶解度,二乙二醇二甲醚能与水分子形成氢键,增加了在水中的溶解度。
BH₃或BH₃·THF;③二乙二醇二甲醚、水属于极性分子,苯为非极性分子,根据“相似相溶”原理,二乙二醇二甲醚在水中的溶解度大于在苯中的溶解度,二乙二醇二甲醚能与水分子形成氢键,增加了在水中的溶解度。
(3)①根据α型立方晶体可知,以一个棱上的BH₄⁻为基准,距离最近的BH₄⁻之间的距离是边长的$\frac{\sqrt{2}}{2}$,即离BH₄⁻最近的BH₄⁻有12个;②在四方晶体中,A的坐标为(0,0,0),B的坐标为($\frac{1}{2}a$,$\frac{1}{2}a$,$\frac{3}{2}a$),A、B间的距离是$\sqrt{(\frac{1}{2}a)^2 + (\frac{1}{2}a)^2 + (\frac{3}{2}a)^2}$ = $\frac{\sqrt{14}}{2}a$nm。
巩固训练3
(1)O>C>H>B B
(2)①4
 + 3NaBH₄ + BF₃ = 4
+ 3NaBH₄ + BF₃ = 4 BH₃ + 3NaF ②sp²→sp³ NaBH₄、BH₃·THF ③二乙二醇二甲醚和水都是极性分子,同时二乙二醇二甲醚能与水分子形成氢键
BH₃ + 3NaF ②sp²→sp³ NaBH₄、BH₃·THF ③二乙二醇二甲醚和水都是极性分子,同时二乙二醇二甲醚能与水分子形成氢键 (3)①12 ②$\frac{\sqrt{14}}{2}a$
解析:
(1)BH₃·THF中组成元素为H、C、O、B,该物质为还原性物质,遇水放出氢气,推断出BH₃中H显负价,即H的电负性强于B,同周期从左向右电负性增大,四种元素电负性由大到小顺序是O>C>H>B;1s²2s²2p¹是基态B原子,能量低;1s²2s¹2p¹是B激发态,能量高;1s²2p²是B激发态,能量高;综上所述,失去一个电子所需能量最大的是1s²2s²。
(2)①根据题意,制备BH₃·THF的化学方程式为4
 + 3NaBH₄ + BF₃ = 4
+ 3NaBH₄ + BF₃ = 4 BH₃ + 3NaF;②BF₃中B的价层电子对数为$\frac{3 + 3×1}{2}$ = 3,杂化类型为sp²,依据硼烷 - 四氢呋喃的结构简式,推出B的杂化类型为sp³,即制备过程中B的杂化方式变化为sp²→sp³,BH₃中B形成三个σ键,B还有一个空轨道,能容纳孤电子对,形成配位键,因此含配位键的是NaBH₄、
BH₃ + 3NaF;②BF₃中B的价层电子对数为$\frac{3 + 3×1}{2}$ = 3,杂化类型为sp²,依据硼烷 - 四氢呋喃的结构简式,推出B的杂化类型为sp³,即制备过程中B的杂化方式变化为sp²→sp³,BH₃中B形成三个σ键,B还有一个空轨道,能容纳孤电子对,形成配位键,因此含配位键的是NaBH₄、 BH₃或BH₃·THF;③二乙二醇二甲醚、水属于极性分子,苯为非极性分子,根据“相似相溶”原理,二乙二醇二甲醚在水中的溶解度大于在苯中的溶解度,二乙二醇二甲醚能与水分子形成氢键,增加了在水中的溶解度。
BH₃或BH₃·THF;③二乙二醇二甲醚、水属于极性分子,苯为非极性分子,根据“相似相溶”原理,二乙二醇二甲醚在水中的溶解度大于在苯中的溶解度,二乙二醇二甲醚能与水分子形成氢键,增加了在水中的溶解度。(3)①根据α型立方晶体可知,以一个棱上的BH₄⁻为基准,距离最近的BH₄⁻之间的距离是边长的$\frac{\sqrt{2}}{2}$,即离BH₄⁻最近的BH₄⁻有12个;②在四方晶体中,A的坐标为(0,0,0),B的坐标为($\frac{1}{2}a$,$\frac{1}{2}a$,$\frac{3}{2}a$),A、B间的距离是$\sqrt{(\frac{1}{2}a)^2 + (\frac{1}{2}a)^2 + (\frac{3}{2}a)^2}$ = $\frac{\sqrt{14}}{2}a$nm。
巩固训练4 (2025·河北邢台三模) 铜及其化合物用途广泛。回答下列问题:
(1)Cu在元素周期表中位于第
(2)蓝矾的简单结构如图1。
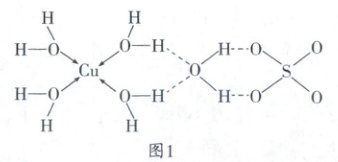
蓝矾晶体中形成配位键时
(3)(3)二维导电金属——有机框架(MOFs)因其在超级电容器、电化学传感器、电催化剂和电池等方面的潜在应用而受到越来越多的关注。合成MOFs的一种方法如下。
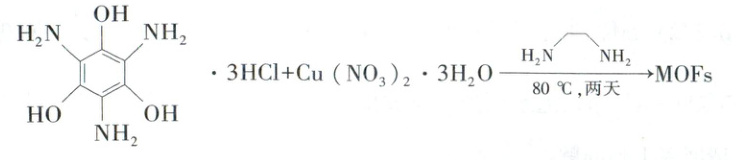
固态 的晶体类型是_________。
的晶体类型是_________。 中 N 原子的杂化方式是_________。
中 N 原子的杂化方式是_________。
(4)一种含铜的多元金属硫化物的晶胞结构为四方晶系,已知金属原子均呈四面体配位,晶胞棱边夹角均为90°,其结构可看作是由两个立方体A、B上下堆叠而成。图2为A沿体对角线的投影图,图3为B沿$y$轴方向的投影图。A中Fe、Sn位置互换即为B。立方体A、B棱长均为$a$ pm,晶胞中部分原子的分数坐标为S(0,0,0)、Fe$\begin{pmatrix} \frac {3}{4},\frac {1}{4},\frac {1}{8}\end{pmatrix}$。
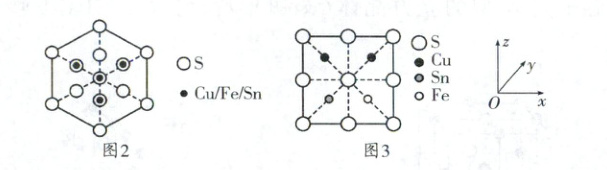
晶胞中Sn原子的分数坐标为
(1)Cu在元素周期表中位于第
四
周期第IB
族;基态Cu²⁺核外有1
个未成对电子。(2)蓝矾的简单结构如图1。

蓝矾晶体中形成配位键时
Cu²⁺
提供空轨道。SO₄²⁻的空间结构为正四面体
。蓝矾晶体中形成配位键的H₂O分子的H—O—H键角>
(填“>”“=”或“<”)104.5°。(3)(3)二维导电金属——有机框架(MOFs)因其在超级电容器、电化学传感器、电催化剂和电池等方面的潜在应用而受到越来越多的关注。合成MOFs的一种方法如下。
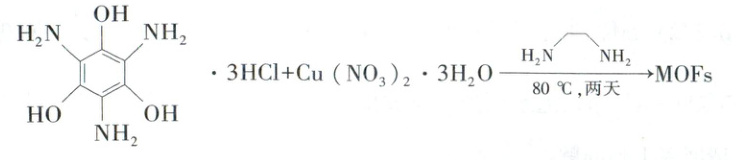
固态
 的晶体类型是_________。
的晶体类型是_________。 中 N 原子的杂化方式是_________。
中 N 原子的杂化方式是_________。(4)一种含铜的多元金属硫化物的晶胞结构为四方晶系,已知金属原子均呈四面体配位,晶胞棱边夹角均为90°,其结构可看作是由两个立方体A、B上下堆叠而成。图2为A沿体对角线的投影图,图3为B沿$y$轴方向的投影图。A中Fe、Sn位置互换即为B。立方体A、B棱长均为$a$ pm,晶胞中部分原子的分数坐标为S(0,0,0)、Fe$\begin{pmatrix} \frac {3}{4},\frac {1}{4},\frac {1}{8}\end{pmatrix}$。

晶胞中Sn原子的分数坐标为
($\frac{1}{4}$,$\frac{3}{4}$,$\frac{1}{8}$) ($\frac{3}{4}$,$\frac{1}{4}$,$\frac{5}{8}$)
。若该晶体的密度为$d$ g·cm⁻³,则阿伏加德罗常数$N_{A}$ =$\frac{4.31×10^{32}}{a^3d}$mol⁻¹
。
答案:
巩固训练4
(1)四 IB 1
(2)Cu²⁺ 正四面体 >
(3)离子晶体 sp³
(4)($\frac{1}{4}$,$\frac{3}{4}$,$\frac{1}{8}$) ($\frac{3}{4}$,$\frac{1}{4}$,$\frac{5}{8}$) $\frac{4.31×10^{32}}{a^3d}$mol⁻¹
解析:
(1)Cu为29号元素,在元素周期表中位于第四周期第ⅠB族;基态Cu原子的价层电子排布式为3d¹⁰4s¹,基态Cu²⁺的价层电子排布式为3d⁹,则基态Cu²⁺核外有1个未成对电子。
(2)由蓝矾的结构可知,其晶体可表示为[Cu(H₂O)₄]SO₄·H₂O,晶体中含Cu—O配位键,其中O提供孤电子对,Cu²⁺提供空轨道。SO₄²⁻的中心原子S的σ键数为4,孤电子对数为$\frac{6 + 2 - 2×4}{2}$ = 0,中心S原子采取sp³杂化,SO₄²⁻的空间结构为正四面体形。水分子中的H—O—H键角为104.5°,蓝矾晶体中形成配位键的水分子的孤电子对参与成键,成键电子对之间的斥力小于水中孤电子对对成键电子对的斥力,蓝矾晶体中形成配位键的H₂O分子的H—O—H键角大于104.5°。
(3) ·3HCl类似于NH₄Cl,属于离子晶体。H₂NCH₂CH₂NH₂分子的氨基中N原子为sp³杂化。
·3HCl类似于NH₄Cl,属于离子晶体。H₂NCH₂CH₂NH₂分子的氨基中N原子为sp³杂化。
(4)根据题意分析该晶体采用面心立方最密堆积,S原子位于立方体A、B的顶点和面心,Cu、Fe、Sn位于体内,1个晶胞中含S原子个数为8×$\frac{1}{8}$ + 10×$\frac{1}{2}$ + 4×$\frac{1}{4}$ + 1 = 8,Cu原子个数为4,Fe原子个数为2,Sn原子个数为2,因此该晶体的化学式为Cu₂FeSnS₄,B在下面,根据图3可以确定B中Sn原子的分数坐标为($\frac{1}{4}$,$\frac{3}{4}$,$\frac{1}{8}$),则A中Sn原子的分数坐标为($\frac{3}{4}$,$\frac{1}{4}$,$\frac{5}{8}$),晶体的密度d = $\frac{(64×4 + 56×2 + 119×2 + 32×8)g·mol^{-1}}{N_A×2a^3×10^{-30}cm^{-3}}$,则N_A = $\frac{4.31×10^{32}}{a^3d}$mol⁻¹。
巩固训练4
(1)四 IB 1
(2)Cu²⁺ 正四面体 >
(3)离子晶体 sp³
(4)($\frac{1}{4}$,$\frac{3}{4}$,$\frac{1}{8}$) ($\frac{3}{4}$,$\frac{1}{4}$,$\frac{5}{8}$) $\frac{4.31×10^{32}}{a^3d}$mol⁻¹
解析:
(1)Cu为29号元素,在元素周期表中位于第四周期第ⅠB族;基态Cu原子的价层电子排布式为3d¹⁰4s¹,基态Cu²⁺的价层电子排布式为3d⁹,则基态Cu²⁺核外有1个未成对电子。
(2)由蓝矾的结构可知,其晶体可表示为[Cu(H₂O)₄]SO₄·H₂O,晶体中含Cu—O配位键,其中O提供孤电子对,Cu²⁺提供空轨道。SO₄²⁻的中心原子S的σ键数为4,孤电子对数为$\frac{6 + 2 - 2×4}{2}$ = 0,中心S原子采取sp³杂化,SO₄²⁻的空间结构为正四面体形。水分子中的H—O—H键角为104.5°,蓝矾晶体中形成配位键的水分子的孤电子对参与成键,成键电子对之间的斥力小于水中孤电子对对成键电子对的斥力,蓝矾晶体中形成配位键的H₂O分子的H—O—H键角大于104.5°。
(3)
 ·3HCl类似于NH₄Cl,属于离子晶体。H₂NCH₂CH₂NH₂分子的氨基中N原子为sp³杂化。
·3HCl类似于NH₄Cl,属于离子晶体。H₂NCH₂CH₂NH₂分子的氨基中N原子为sp³杂化。(4)根据题意分析该晶体采用面心立方最密堆积,S原子位于立方体A、B的顶点和面心,Cu、Fe、Sn位于体内,1个晶胞中含S原子个数为8×$\frac{1}{8}$ + 10×$\frac{1}{2}$ + 4×$\frac{1}{4}$ + 1 = 8,Cu原子个数为4,Fe原子个数为2,Sn原子个数为2,因此该晶体的化学式为Cu₂FeSnS₄,B在下面,根据图3可以确定B中Sn原子的分数坐标为($\frac{1}{4}$,$\frac{3}{4}$,$\frac{1}{8}$),则A中Sn原子的分数坐标为($\frac{3}{4}$,$\frac{1}{4}$,$\frac{5}{8}$),晶体的密度d = $\frac{(64×4 + 56×2 + 119×2 + 32×8)g·mol^{-1}}{N_A×2a^3×10^{-30}cm^{-3}}$,则N_A = $\frac{4.31×10^{32}}{a^3d}$mol⁻¹。
查看更多完整答案,请扫码查看


