2025年学霸高考黑题化学人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年学霸高考黑题化学人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第57页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
经典真题1 (无分支类) (2025·江苏,14,14分)ZnS可用于制备光学材料和回收砷。
(1)制备ZnS。由闪锌矿[含ZnS、FeS及少量硫化镉(CdS)等]制备ZnS的过程如下:
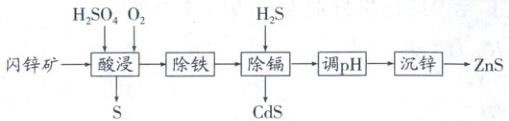
已知:$K_{sp}(ZnS)=1.6×10^{-24}$,$K_{sp}(CdS)=8.0×10^{-27}$,$K_{a1}(H_{2}S)=1.0×10^{-7}$,$K_{a2}(H_{2}S)=1.2×10^{-13}$。当离子浓度小于$1.0×10^{-5}mol· L^{-1}$时,认为离子沉淀完全。
①酸浸时通入$O_{2}$可提高$Zn^{2+}$浸出率的原因是
②通入$H_{2}S$除镉。通过计算判断当溶液$pH = 0$、$c(H_{2}S)=0.01mol· L^{-1}$时,$Cd^{2+}$是否沉淀完全:
③沉锌前调节溶液的pH至4~5,加入的氧化物为
(2)制备光学材料。如图甲所示,ZnS晶体中掺入少量CuCl后,会出现能量不同的“正电”区域、“负电”区域,光照下发出特定波长的光。

区域A“■”中的离子为
(3)回收砷。用ZnS去除酸性废液中的三价砷[As(Ⅲ)],并回收生成的$As_{2}S_{3}$沉淀。
已知:溶液中As(Ⅲ)主要以弱酸$H_{3}AsO_{3}$形式存在,$As_{2}S_{3}+6H_{2}O\rightleftharpoons2H_{3}AsO_{3}+3H_{2}S$。
$60^{\circ}C$时,按$n(S):n(As)=7:1$向酸性废液中加入ZnS,砷回收率随反应时间的变化如图乙所示。
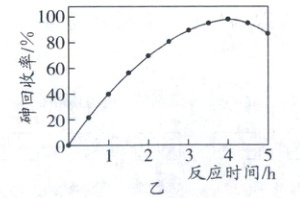
①写出ZnS与$H_{3}AsO_{3}$反应生成$As_{2}S_{3}$的离子方程式:
②反应4h后,砷回收率下降的原因有
(1)制备ZnS。由闪锌矿[含ZnS、FeS及少量硫化镉(CdS)等]制备ZnS的过程如下:

已知:$K_{sp}(ZnS)=1.6×10^{-24}$,$K_{sp}(CdS)=8.0×10^{-27}$,$K_{a1}(H_{2}S)=1.0×10^{-7}$,$K_{a2}(H_{2}S)=1.2×10^{-13}$。当离子浓度小于$1.0×10^{-5}mol· L^{-1}$时,认为离子沉淀完全。
①酸浸时通入$O_{2}$可提高$Zn^{2+}$浸出率的原因是
氧化S²⁻生成S,促进酸浸反应正向进行
。②通入$H_{2}S$除镉。通过计算判断当溶液$pH = 0$、$c(H_{2}S)=0.01mol· L^{-1}$时,$Cd^{2+}$是否沉淀完全:
否。pH = 0、c(H₂S) = 0.01mol·L⁻¹时,c(H⁺) = 1mol·L⁻¹,c(S²⁻) = $\frac{K_{a1}(H₂S)·K_{a2}(H₂S)·c(H₂S)}{c²(H⁺)}$ = $\frac{1.0×10^{-7}×1.2×10^{-13}×0.01}{1²}$mol·L⁻¹ = 1.2×10⁻²²mol·L⁻¹,c(Cd²⁺) = $\frac{K_{sp}(CdS)}{c(S²⁻)}$ = $\frac{8.0×10^{-27}}{1.2×10^{-22}}$mol·L⁻¹ ≈ 6.67×10⁻⁵mol·L⁻¹ > 1.0×10⁻⁵mol·L⁻¹,则Cd²⁺未沉淀完全
(写出计算过程)。③沉锌前调节溶液的pH至4~5,加入的氧化物为
ZnO
(填化学式)。(2)制备光学材料。如图甲所示,ZnS晶体中掺入少量CuCl后,会出现能量不同的“正电”区域、“负电”区域,光照下发出特定波长的光。

区域A“■”中的离子为
Cl⁻
(填离子符号),区域B带负电
(填“正电”或“负电”)。(3)回收砷。用ZnS去除酸性废液中的三价砷[As(Ⅲ)],并回收生成的$As_{2}S_{3}$沉淀。
已知:溶液中As(Ⅲ)主要以弱酸$H_{3}AsO_{3}$形式存在,$As_{2}S_{3}+6H_{2}O\rightleftharpoons2H_{3}AsO_{3}+3H_{2}S$。
$60^{\circ}C$时,按$n(S):n(As)=7:1$向酸性废液中加入ZnS,砷回收率随反应时间的变化如图乙所示。

①写出ZnS与$H_{3}AsO_{3}$反应生成$As_{2}S_{3}$的离子方程式:
2H₃AsO₃ + 3ZnS + 6H⁺ = As₂S₃ + 3Zn²⁺ + 6H₂O
。②反应4h后,砷回收率下降的原因有
随着反应的进行,溶液pH增大,溶液中H₂S浓度减小,促进As₂S₃ + 6H₂O ⇌ 2H₃AsO₃ + 3H₂S平衡正向移动,As₂S₃重新溶解,砷回收率下降
。
答案:
经典真题1
(1)①氧化S²⁻生成S,促进酸浸反应正向进行 ②否。pH = 0、c(H₂S) = 0.01mol·L⁻¹时,c(H⁺) = 1mol·L⁻¹,c(S²⁻) = $\frac{K_{a1}(H₂S)·K_{a2}(H₂S)·c(H₂S)}{c²(H⁺)}$ = $\frac{1.0×10^{-7}×1.2×10^{-13}×0.01}{1²}$mol·L⁻¹ = 1.2×10⁻²²mol·L⁻¹,c(Cd²⁺) = $\frac{K_{sp}(CdS)}{c(S²⁻)}$ = $\frac{8.0×10^{-27}}{1.2×10^{-22}}$mol·L⁻¹ ≈ 6.67×10⁻⁵mol·L⁻¹ > 1.0×10⁻⁵mol·L⁻¹,则Cd²⁺未沉淀完全 ③ZnO
(2)Cl⁻ 负电
(3)①2H₃AsO₃ + 3ZnS + 6H⁺ = As₂S₃ + 3Zn²⁺ + 6H₂O ②随着反应的进行,溶液pH增大,溶液中H₂S浓度减小,促进As₂S₃ + 6H₂O ⇌ 2H₃AsO₃ + 3H₂S平衡正向移动,As₂S₃重新溶解,砷回收率下降
解题思路

流程解读
酸浸 加入H₂SO₄、O₂酸浸后,ZnS、FeS、CdS分别转化为Zn²⁺、Fe³⁺、Cd²⁺,S元素转化为S单质
除铁 和解题无关,流程图中未给出除铁的方法
除镉 通入H₂S除镉,H₂S电离生成S²⁻,利用沉淀溶解平衡,发生反应Cd²⁺ + S²⁻ ⇌ CdS↓
调pH除镉时溶液酸性较强;pH = 0。沉锌前调节溶液的pH至4 - 5,应在不引入新杂质的同时消耗溶液中的H⁺,加入的氧化物为ZnO
沉锌 调节pH后,H⁺浓度降低,促进了溶液中H₂S的电离,平衡正向移动,增大了S²⁻浓度,利用沉淀溶解平衡,发生反应Zn²⁺ + S²⁻ = ZnS↓
解析:
(1)①酸浸时,若不通入O₂,会发生反应:ZnS + H₂SO₄ ⇌ ZnSO₄ + H₂S↑,通入O₂可以氧化S²⁻生成S,促进酸浸反应正向进行,提高Zn²⁺浸出率;②通入H₂S除镉,当溶液pH = 0、c(H₂S) = 0.01mol·L⁻¹时,c(H⁺) = 1mol·L⁻¹,又因为Kₐ₁(H₂S) = 1.0×10⁻⁷,Kₐ₂(H₂S) = 1.2×10⁻¹³,Kₐ₁(H₂S)×Kₐ₂(H₂S) = $\frac{c(H⁺)×c(HS⁻)}{c(H₂S)}$×$\frac{c(H⁺)×c(S²⁻)}{c(HS⁻)}$ = $\frac{c²(H⁺)×c(S²⁻)}{c(H₂S)}$,则c(S²⁻) = $\frac{1×10^{-7}×1.2×10^{-13}×0.01}{1²}$mol·L⁻¹ = 1.2×10⁻²²mol·L⁻¹,则此时c(Cd²⁺) = $\frac{K_{sp}(CdS)}{c(S²⁻)}$ = $\frac{8.0×10^{-27}}{1.2×10^{-22}}$mol·L⁻¹ ≈ 6.67×10⁻⁵mol·L⁻¹,此时Cd²⁺的浓度大于1.0×10⁻⁵mol·L⁻¹,离子沉淀不完全。
(2)晶胞掺杂过程中,应由半径相近的微粒进行替换,则区域A中,由Cl⁻替换S²⁻,区域B中,由Cu⁺替换Zn²⁺;按照均摊法,区域B中含Zn²⁺:3个、Cu⁺:1个、S²⁻:8×$\frac{1}{8}$ + 6×$\frac{1}{2}$ = 4个,(+2)×3 + (+1)×1 + (-2)×4 = -1,则区域B带负电。
(3)①根据质量守恒、电荷守恒和题给信息“酸性废液”,ZnS与H₃AsO₃反应除了生成As₂S₃外还有锌离子。
经典真题1
(1)①氧化S²⁻生成S,促进酸浸反应正向进行 ②否。pH = 0、c(H₂S) = 0.01mol·L⁻¹时,c(H⁺) = 1mol·L⁻¹,c(S²⁻) = $\frac{K_{a1}(H₂S)·K_{a2}(H₂S)·c(H₂S)}{c²(H⁺)}$ = $\frac{1.0×10^{-7}×1.2×10^{-13}×0.01}{1²}$mol·L⁻¹ = 1.2×10⁻²²mol·L⁻¹,c(Cd²⁺) = $\frac{K_{sp}(CdS)}{c(S²⁻)}$ = $\frac{8.0×10^{-27}}{1.2×10^{-22}}$mol·L⁻¹ ≈ 6.67×10⁻⁵mol·L⁻¹ > 1.0×10⁻⁵mol·L⁻¹,则Cd²⁺未沉淀完全 ③ZnO
(2)Cl⁻ 负电
(3)①2H₃AsO₃ + 3ZnS + 6H⁺ = As₂S₃ + 3Zn²⁺ + 6H₂O ②随着反应的进行,溶液pH增大,溶液中H₂S浓度减小,促进As₂S₃ + 6H₂O ⇌ 2H₃AsO₃ + 3H₂S平衡正向移动,As₂S₃重新溶解,砷回收率下降
解题思路

流程解读
酸浸 加入H₂SO₄、O₂酸浸后,ZnS、FeS、CdS分别转化为Zn²⁺、Fe³⁺、Cd²⁺,S元素转化为S单质
除铁 和解题无关,流程图中未给出除铁的方法
除镉 通入H₂S除镉,H₂S电离生成S²⁻,利用沉淀溶解平衡,发生反应Cd²⁺ + S²⁻ ⇌ CdS↓
调pH除镉时溶液酸性较强;pH = 0。沉锌前调节溶液的pH至4 - 5,应在不引入新杂质的同时消耗溶液中的H⁺,加入的氧化物为ZnO
沉锌 调节pH后,H⁺浓度降低,促进了溶液中H₂S的电离,平衡正向移动,增大了S²⁻浓度,利用沉淀溶解平衡,发生反应Zn²⁺ + S²⁻ = ZnS↓
解析:
(1)①酸浸时,若不通入O₂,会发生反应:ZnS + H₂SO₄ ⇌ ZnSO₄ + H₂S↑,通入O₂可以氧化S²⁻生成S,促进酸浸反应正向进行,提高Zn²⁺浸出率;②通入H₂S除镉,当溶液pH = 0、c(H₂S) = 0.01mol·L⁻¹时,c(H⁺) = 1mol·L⁻¹,又因为Kₐ₁(H₂S) = 1.0×10⁻⁷,Kₐ₂(H₂S) = 1.2×10⁻¹³,Kₐ₁(H₂S)×Kₐ₂(H₂S) = $\frac{c(H⁺)×c(HS⁻)}{c(H₂S)}$×$\frac{c(H⁺)×c(S²⁻)}{c(HS⁻)}$ = $\frac{c²(H⁺)×c(S²⁻)}{c(H₂S)}$,则c(S²⁻) = $\frac{1×10^{-7}×1.2×10^{-13}×0.01}{1²}$mol·L⁻¹ = 1.2×10⁻²²mol·L⁻¹,则此时c(Cd²⁺) = $\frac{K_{sp}(CdS)}{c(S²⁻)}$ = $\frac{8.0×10^{-27}}{1.2×10^{-22}}$mol·L⁻¹ ≈ 6.67×10⁻⁵mol·L⁻¹,此时Cd²⁺的浓度大于1.0×10⁻⁵mol·L⁻¹,离子沉淀不完全。
(2)晶胞掺杂过程中,应由半径相近的微粒进行替换,则区域A中,由Cl⁻替换S²⁻,区域B中,由Cu⁺替换Zn²⁺;按照均摊法,区域B中含Zn²⁺:3个、Cu⁺:1个、S²⁻:8×$\frac{1}{8}$ + 6×$\frac{1}{2}$ = 4个,(+2)×3 + (+1)×1 + (-2)×4 = -1,则区域B带负电。
(3)①根据质量守恒、电荷守恒和题给信息“酸性废液”,ZnS与H₃AsO₃反应除了生成As₂S₃外还有锌离子。
经典真题2 (有分支类) (2025·云南,15,14分)从褐铁矿型金-银矿(含Au、Ag、$Fe_{2}O_{3}$、$MnO_{2}$、CuO、$SiO_{2}$等)中提取Au、Ag,并回收其他有价金属的一种工艺如下:
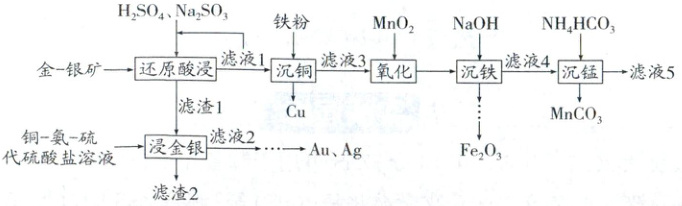
已知:①金-银矿中Cu、Mn元素的含量分别为0.19%、2.35%。
②$25^{\circ}C$时,$Mn(OH)_{2}$的$K_{sp}$为$1.9×10^{-13}$。
回答下列问题:
(1)基态Cu原子的价层电子排布式为
(2)“还原酸浸”时,$MnO_{2}$反应的离子方程式为
(3)“浸金银”时,Au溶解涉及的主要反应如下:
①$Au+5S_{2}O_{3}^{2-}+[Cu(NH_{3})_{4}]^{2+}=[Au(S_{2}O_{3})_{2}]^{3-}+[Cu(S_{2}O_{3})_{3}]^{5-}+4NH_{3}$
②$4[Cu(S_{2}O_{3})_{3}]^{5-}+16NH_{3}+O_{2}+2H_{2}O=4[Cu(NH_{3})_{4}]^{2+}+4OH^{-}+12S_{2}O_{3}^{2-}$
上述过程中的催化剂为
(4)“沉铜”前,“滤液1”多次循环的目的为
(5)根据“还原酸浸”“氧化”,推断$Fe^{3+}$、$Cu^{2+}$、$MnO_{2}$的氧化性由强到弱的顺序为
(6)$25^{\circ}C$“沉铁”后,调节“滤液4”的pH至8.0,无$Mn(OH)_{2}$析出,则$c(Mn^{2+})\leq$
(7)一种锑锰($Mn_{3}Sb$)合金的立方晶胞结构如图。

①该晶胞中,每个Sb周围与它最近且相等距离的Mn有
②$N_{A}$为阿伏加德罗常数的值,晶胞边长为$a$nm,则晶体的密度为

已知:①金-银矿中Cu、Mn元素的含量分别为0.19%、2.35%。
②$25^{\circ}C$时,$Mn(OH)_{2}$的$K_{sp}$为$1.9×10^{-13}$。
回答下列问题:
(1)基态Cu原子的价层电子排布式为
3d¹⁰4s¹
。(2)“还原酸浸”时,$MnO_{2}$反应的离子方程式为
MnO₂ + SO₃²⁻ + 2H⁺ = Mn²⁺ + SO₄²⁻ + H₂O
。(3)“浸金银”时,Au溶解涉及的主要反应如下:
①$Au+5S_{2}O_{3}^{2-}+[Cu(NH_{3})_{4}]^{2+}=[Au(S_{2}O_{3})_{2}]^{3-}+[Cu(S_{2}O_{3})_{3}]^{5-}+4NH_{3}$
②$4[Cu(S_{2}O_{3})_{3}]^{5-}+16NH_{3}+O_{2}+2H_{2}O=4[Cu(NH_{3})_{4}]^{2+}+4OH^{-}+12S_{2}O_{3}^{2-}$
上述过程中的催化剂为
[Cu(NH₃)₄]²⁺
。(4)“沉铜”前,“滤液1”多次循环的目的为
大幅度降低硫酸和亚硫酸钠的消耗成本,同时减少废水产生量及处理成本,并通过持续去除杂质提高金银的富含度
。(5)根据“还原酸浸”“氧化”,推断$Fe^{3+}$、$Cu^{2+}$、$MnO_{2}$的氧化性由强到弱的顺序为
MnO₂ > Fe³⁺ > Cu²⁺
。(6)$25^{\circ}C$“沉铁”后,调节“滤液4”的pH至8.0,无$Mn(OH)_{2}$析出,则$c(Mn^{2+})\leq$
0.19
$mol· L^{-1}$。(7)一种锑锰($Mn_{3}Sb$)合金的立方晶胞结构如图。

①该晶胞中,每个Sb周围与它最近且相等距离的Mn有
12
个。②$N_{A}$为阿伏加德罗常数的值,晶胞边长为$a$nm,则晶体的密度为
$\frac{122 + 55×3}{N_A×a³×10^{-21}}$
$g· cm^{-3}$(列出计算式即可)。
答案:
经典真题2
(1)3d¹⁰4s¹
(2)MnO₂ + SO₃²⁻ + 2H⁺ = Mn²⁺ + SO₄²⁻ + H₂O
(3)[Cu(NH₃)₄]²⁺
(4)大幅度降低硫酸和亚硫酸钠的消耗成本,同时减少废水产生量及处理成本,并通过持续去除杂质提高金银的富含度
(5)MnO₂ > Fe³⁺ > Cu²⁺
(6)0.19
(7)①12 ②$\frac{122 + 55×3}{N_A×a³×10^{-21}}$
解题思路

流程解读
还原酸浸 Fe₂O₃、MnO₂被还原为Fe²⁺和Mn²⁺,发生反应:Fe₂O₃ + SO₃²⁻ + 4H⁺ = 2Fe²⁺ + SO₄²⁻ + 2H₂O,MnO₂ + SO₃²⁻ + 2H⁺ = Mn²⁺ + SO₄²⁻ + H₂O,CuO被溶解为Cu²⁺,发生反应:CuO + 2H⁺ = Cu²⁺ + H₂O,进入“滤液1”;Au、Ag、SiO₂不溶,进入“滤渣1”
浸金银 Au、Ag被铜 - 氨 - 硫代硫酸盐溶液浸出,进入“滤液2”,SiO₂不溶,进入“滤渣2”
沉铜 Cu²⁺被铁粉还原为Cu,发生反应:Cu²⁺ + Fe = Cu + Fe²⁺
氧化 Fe²⁺被MnO₂氧化为Fe³⁺,发生反应:2Fe²⁺ + MnO₂ + 4H⁺ = 2Fe³⁺ + Mn²⁺ + 2H₂O
沉铁 Fe³⁺转化为Fe(OH)₃沉淀,后续转化为Fe₂O₃,发生反应:Fe³⁺ + 3OH⁻ = Fe(OH)₃↓,2Fe(OH)₃ = Fe₂O₃ + 3H₂O
沉锰 Mn²⁺与NH₄HCO₃反应转化为MnCO₃沉淀
解析:
(1)Cu为29号元素,基态Cu原子的核外电子排布属于洪特规则的特例,其价电子数为11,其价层电子排布式为3d¹⁰4s¹。
(2)“还原酸浸”时,MnO₂被亚硫酸钠还原为Mn²⁺,该反应的离子方程式为MnO₂ + SO₃²⁻ + 2H⁺ = Mn²⁺ + SO₄²⁻ + H₂O。
(3)“浸金银”时,分析Au溶解涉及的主要反应可知,[Cu(NH₃)₄]²⁺参与了反应①,但在反应②又重新生成,其质量和化学性质在反应前后没发生变化,因此,上述过程中的催化剂为[Cu(NH₃)₄]²⁺。
(4)“还原酸浸”所得“滤液1”中含有一定浓度的未反应的硫酸和亚硫酸钠,多次循环利用“滤液1”对矿石进行“还原酸浸”可以充分利用其中的有效成分,大大减少了原料的浪费,从而有效降低成本;其次,持续地将杂质元素溶解并带出矿石体系,可以使矿石中的金银的相对品位得到提升,为后续提纯工序创造更好的条件;第三,还可以减少废水的排放量和处理成本;第四,可以回收更多的有价值的溶解成分。
(5)“还原酸浸”时,Fe₂O₃和CuO可以被硫酸溶解转化为Fe³⁺和Cu²⁺,亚硫酸钠将Fe³⁺还原为Fe²⁺,而Cu²⁺并未被还原,因此,Fe³⁺的氧化性强于Cu²⁺;“氧化”时,Fe²⁺被MnO₂氧化为Fe³⁺,因此,MnO₂的氧化性强于Fe³⁺。
(6)25℃“沉铁”后,调节“滤液4”的pH至8.0,此时c(OH⁻) = 10⁻⁶mol·L⁻¹,无Mn(OH)₂析出,根据Mn(OH)₂的Kₛₚ为1.9×10⁻¹³,则c(Mn²⁺) ≤ $\frac{1.9×10^{-13}}{(10^{-6})²}$ = 0.19(mol·L⁻¹)。
(7)由晶胞结构可知,该晶胞为面心立方,Sb位于晶胞的顶点,其与邻近的3个面的面心上的Mn距离最近且距离相等,每个顶点参与形成8个晶胞,而每个面心参与形成2个晶胞,因此,该晶胞中,每个Sb周围与它最近且相等距离的Mn有$\frac{3×8}{2}$ = 12个;②由晶胞结构和均摊法可知,该晶胞中平均占有1个Sb和3个Mn,因此,该晶胞的质量为$\frac{122 + 55×3}{N_A}$g,该晶胞的体积为(anm)³ = a×10⁻²¹cm³,晶体的密度为$\frac{(122 + 55×3)g}{N_A×a³×10^{-21}cm³}$ = $\frac{122 + 55×3}{N_A×a³×10^{-21}}$g·cm⁻³。
经典真题2
(1)3d¹⁰4s¹
(2)MnO₂ + SO₃²⁻ + 2H⁺ = Mn²⁺ + SO₄²⁻ + H₂O
(3)[Cu(NH₃)₄]²⁺
(4)大幅度降低硫酸和亚硫酸钠的消耗成本,同时减少废水产生量及处理成本,并通过持续去除杂质提高金银的富含度
(5)MnO₂ > Fe³⁺ > Cu²⁺
(6)0.19
(7)①12 ②$\frac{122 + 55×3}{N_A×a³×10^{-21}}$
解题思路

流程解读
还原酸浸 Fe₂O₃、MnO₂被还原为Fe²⁺和Mn²⁺,发生反应:Fe₂O₃ + SO₃²⁻ + 4H⁺ = 2Fe²⁺ + SO₄²⁻ + 2H₂O,MnO₂ + SO₃²⁻ + 2H⁺ = Mn²⁺ + SO₄²⁻ + H₂O,CuO被溶解为Cu²⁺,发生反应:CuO + 2H⁺ = Cu²⁺ + H₂O,进入“滤液1”;Au、Ag、SiO₂不溶,进入“滤渣1”
浸金银 Au、Ag被铜 - 氨 - 硫代硫酸盐溶液浸出,进入“滤液2”,SiO₂不溶,进入“滤渣2”
沉铜 Cu²⁺被铁粉还原为Cu,发生反应:Cu²⁺ + Fe = Cu + Fe²⁺
氧化 Fe²⁺被MnO₂氧化为Fe³⁺,发生反应:2Fe²⁺ + MnO₂ + 4H⁺ = 2Fe³⁺ + Mn²⁺ + 2H₂O
沉铁 Fe³⁺转化为Fe(OH)₃沉淀,后续转化为Fe₂O₃,发生反应:Fe³⁺ + 3OH⁻ = Fe(OH)₃↓,2Fe(OH)₃ = Fe₂O₃ + 3H₂O
沉锰 Mn²⁺与NH₄HCO₃反应转化为MnCO₃沉淀
解析:
(1)Cu为29号元素,基态Cu原子的核外电子排布属于洪特规则的特例,其价电子数为11,其价层电子排布式为3d¹⁰4s¹。
(2)“还原酸浸”时,MnO₂被亚硫酸钠还原为Mn²⁺,该反应的离子方程式为MnO₂ + SO₃²⁻ + 2H⁺ = Mn²⁺ + SO₄²⁻ + H₂O。
(3)“浸金银”时,分析Au溶解涉及的主要反应可知,[Cu(NH₃)₄]²⁺参与了反应①,但在反应②又重新生成,其质量和化学性质在反应前后没发生变化,因此,上述过程中的催化剂为[Cu(NH₃)₄]²⁺。
(4)“还原酸浸”所得“滤液1”中含有一定浓度的未反应的硫酸和亚硫酸钠,多次循环利用“滤液1”对矿石进行“还原酸浸”可以充分利用其中的有效成分,大大减少了原料的浪费,从而有效降低成本;其次,持续地将杂质元素溶解并带出矿石体系,可以使矿石中的金银的相对品位得到提升,为后续提纯工序创造更好的条件;第三,还可以减少废水的排放量和处理成本;第四,可以回收更多的有价值的溶解成分。
(5)“还原酸浸”时,Fe₂O₃和CuO可以被硫酸溶解转化为Fe³⁺和Cu²⁺,亚硫酸钠将Fe³⁺还原为Fe²⁺,而Cu²⁺并未被还原,因此,Fe³⁺的氧化性强于Cu²⁺;“氧化”时,Fe²⁺被MnO₂氧化为Fe³⁺,因此,MnO₂的氧化性强于Fe³⁺。
(6)25℃“沉铁”后,调节“滤液4”的pH至8.0,此时c(OH⁻) = 10⁻⁶mol·L⁻¹,无Mn(OH)₂析出,根据Mn(OH)₂的Kₛₚ为1.9×10⁻¹³,则c(Mn²⁺) ≤ $\frac{1.9×10^{-13}}{(10^{-6})²}$ = 0.19(mol·L⁻¹)。
(7)由晶胞结构可知,该晶胞为面心立方,Sb位于晶胞的顶点,其与邻近的3个面的面心上的Mn距离最近且距离相等,每个顶点参与形成8个晶胞,而每个面心参与形成2个晶胞,因此,该晶胞中,每个Sb周围与它最近且相等距离的Mn有$\frac{3×8}{2}$ = 12个;②由晶胞结构和均摊法可知,该晶胞中平均占有1个Sb和3个Mn,因此,该晶胞的质量为$\frac{122 + 55×3}{N_A}$g,该晶胞的体积为(anm)³ = a×10⁻²¹cm³,晶体的密度为$\frac{(122 + 55×3)g}{N_A×a³×10^{-21}cm³}$ = $\frac{122 + 55×3}{N_A×a³×10^{-21}}$g·cm⁻³。
查看更多完整答案,请扫码查看


