2025年学霸高考黑题化学人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年学霸高考黑题化学人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第83页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
利用绿矾 $ (FeSO_4 · 7H_2O) $ 为原料制备高纯补铁剂乙二胺四乙酸铁钠晶体 $ (NaFeY · 3H_2O) $ 的工艺流程如下:

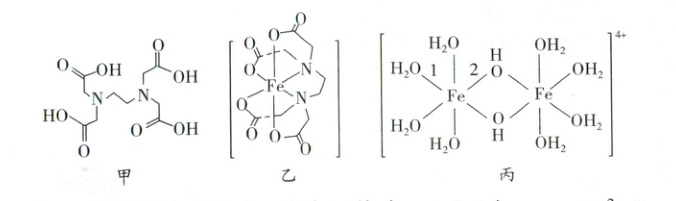


已知:ⅰ.乙二胺四乙酸(${H_{4}Y}$)微溶于冷水,易溶于热水;$25^{\circ}C$时,$K_{a1}=10^{-2}$,$K_{a2}=10^{-2.7}$,$K_{a3}=10^{-6}$,$K_{a4}=10^{-10.3}$;${H_{4}Y}$结构如图甲。
ⅱ.$25^{\circ}C$时,$K_{sp}[{Fe(OH)_{3}}]=10^{-37.4}$;${Fe^{3+}(aq) +Y^{4-}(aq)⇌[FeY]^{-}(aq)}$ $K = 10^{25.1}$;$[{FeY}]^{-}$结构如图乙。
回答下列问题:
(1)“沉铁”生成${FeCO_{3}}$的离子方程式为___。
(2)“氧化”生成${Fe(OH)_{3}}$的化学方程式为___。
(3)“沉铁”和“氧化”也可用${FeCl_{3}·6H_{2}O}$与${NaHCO_{3}}$一步反应完成。
已知:i.${Fe^{3+}}$水解过程先生成碱式盐,再聚合生成多核阳离子,如$[{Fe_{2}(OH)_{2}(H_{2}O)_{8}}]^{4+}$,结构如图丙。
ii.${FeCO_{3}}$颗粒大,易沉降。
①键长:$1$___$2$(填“$>$”“$<$”或“$=$”)。
②结合$[{Fe_{2}(OH)_{2}(H_{2}O)_{8}}]^{4+}$的结构分析,绿矾两步反应制备${Fe(OH)_{3}}$的优点有___。
(4)①“合成”反应${Fe(OH)_{3}(s) +H_{4}Y(aq) +OH^{-}(aq)\xlongequal{}[FeY]^{-}(aq) +4H_{2}O(l)}$的平衡常数$K'=$___;此时溶液中未参与配位的含$Y$主要微粒为___。
②相较于${H_{4}Y}$,$[{FeY}]^{-}$中${C-N}$键极性会___(填“增大”“减小”或“不变”)。
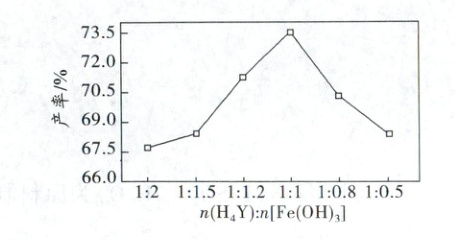
③将${NaOH}$、${H_{4}Y}$、${Fe(OH)_{3}}$固体加入水中,保持${NaOH}$用量不变,${NaFeY}$产率随$\dfrac{n({H_{4}Y})}{n[{Fe(OH)_{3}}]}$的变化关系如图。$\dfrac{n({H_{4}Y})}{n[{Fe(OH)_{3}}]}>1$时,产率减小的原因 为___。

(5)操作 X 为____(填字母)。
a. 热水洗涤
b. 冷水洗涤
c. 硫酸洗涤
(6)利用“滤液 1”三室电解后的阴极产物溶液吸收“气体 1”“气体 2”,吸收液可在流程中循环使用,利用该吸收液的操作单元为____。
答案:
巩固训练5
(1)$Fe^{2+}+2HCO_3^-=FeCO_3↓+CO_2↑+H_2O$
(2)$2FeCO_3+H_2O_2+2H_2O=2Fe(OH)_3+2CO_2↑$
(3)①> ②生成大颗粒的$FeCO_3$沉淀易于分离;$Fe^{3+}$水解生成的阳离子易与水分子形成氢键,生成絮状沉淀,难以洗脱
(4)①$10^{22.7}$ $H_2Y^{2-}$ ②减小 ③溶液呈酸性,N原子易与$H^+$配位且$COO^-$易与$H^+$结合,降低配位能力
(5)b
(6)沉铁
解题思路
利用绿矾$(FeSO_4·7H_2O)$为原料制备高纯补铁剂乙二胺四乙酸铁钠晶体$(NaFeY·3H_2O)$,“沉铁”中绿矾与碳酸氢钠$(NaHCO_3)$反应生成碳酸亚铁$(FeCO_3)$沉淀,同时有二氧化碳气体生成,“氧化”中$FeCO_3$被$H_2O_2$氧化为$Fe(OH)_3$沉淀,同时有二氧化碳气体生成,“合成”中氢氧化铁、$NaOH$与乙二胺四乙酸反应生成$NaFeY$溶液,经过减压过滤,蒸发浓缩,冷却结晶,过滤,洗涤干燥得到$NaFeY·3H_2O$晶体。
解析:
(3)①由$[Fe_2(OH)_2(H_2O)_8]^{4+}$的结构可知,键1为Fe与O形成的配位键,O原子同时与1个Fe和2个H成键,电子云集中在Fe与O之间,键2中O原子同时与2个Fe和1个H成键,Fe的电负性较小,对O的电子云吸引较弱,O原子周围电子云密度较大,导致对Fe的吸引增强,键长较短,则键长:1>2;②结合$[Fe_2(OH)_2(H_2O)_8]^{4+}$的结构分析,绿矾两步反应制备$Fe(OH)_3$的优点有生成大颗粒的$FeCO_3$沉淀易于分离;$Fe^{3+}$水解生成的阳离子易与水分子形成氢键,生成絮状沉淀,难以洗脱。
(4)①$Fe(OH)_3(s)+H_4Y(aq)+OH^-(aq)=[FeY]^-(aq)+4H_2O(l)$的平衡常数$K'=\frac{c\{[FeY]^-\}}{c(H_4Y)c(OH^-)}=\frac{c\{[FeY]^-\}c(Fe^{3+})c^3(OH^-)c(Y^{4-})}{c(H_4Y)c^4(OH^-)c(Fe^{3+})c(Y^{4-})}=\frac{K_1×K_2×K_3×K×K_{sp}[Fe(OH)_3]×K}{(K_w)^4}=\frac{10^{-2}×10^{-2.7}×10^{-6}×10^{-10.3}×10^{-37.4}×10^{25.1}}{(10^{-14})^4}=10^{22.7}$;当溶液中$c(H_2Y^{2-})=c(HY^-)$时,$c(H^+)=\frac{c(H_2Y^{2-})K_{a2}}{c(HY^-)}=K_{a2}=10^{-2.7}mol·L^{-1}$,$pH=2.7$,当溶液中$c(H_2Y^{2-})=c(HY^-)$时,$c(H^+)=\frac{c(H_2Y^{2-})K_{a3}}{c(HY^{3-})}=K_{a3}=10^{-6}mol·L^{-1}$,$pH=6$,说明pH=5时,溶液中主要存在的形态为$H_2Y^{2-}$,因此未配位的含Y主要微粒为$H_2Y^{2-}$;②$H_4Y$中的C—N键由于N原子电负性较大,电子云偏向N,键极性较强,配位后N原子与$Fe^{3+}$成配位键,电子云向金属离子偏移,导致N原子电负性降低,从而C—N键的电子云分布更均匀,极性减小;③$\frac{n(H_4Y)}{n[Fe(OH)_3]}>1$时,$NaFeY$产率减小的原因为溶液呈酸性,N原子易与$H^+$配位且$COO^-$易与$H^+$结合,降低配位能力。
(5)$H_4Y$微溶于冷水,易溶于热水,冷水洗涤可减少产物损失,酸洗洗涤可能引入杂质,热水则导致产物溶解,故选b。
(6)“滤液1”为$Na_2SO_4$溶液,电解$Na_2SO_4$溶液时$H_2O$在阴极得到电子生成$H_2$和$NaOH$,气体1和气体2为$CO_2$,过量$CO_2$和$NaOH$溶液反应生成碳酸氢钠,可循环用于沉铁步骤。
(1)$Fe^{2+}+2HCO_3^-=FeCO_3↓+CO_2↑+H_2O$
(2)$2FeCO_3+H_2O_2+2H_2O=2Fe(OH)_3+2CO_2↑$
(3)①> ②生成大颗粒的$FeCO_3$沉淀易于分离;$Fe^{3+}$水解生成的阳离子易与水分子形成氢键,生成絮状沉淀,难以洗脱
(4)①$10^{22.7}$ $H_2Y^{2-}$ ②减小 ③溶液呈酸性,N原子易与$H^+$配位且$COO^-$易与$H^+$结合,降低配位能力
(5)b
(6)沉铁
解题思路
利用绿矾$(FeSO_4·7H_2O)$为原料制备高纯补铁剂乙二胺四乙酸铁钠晶体$(NaFeY·3H_2O)$,“沉铁”中绿矾与碳酸氢钠$(NaHCO_3)$反应生成碳酸亚铁$(FeCO_3)$沉淀,同时有二氧化碳气体生成,“氧化”中$FeCO_3$被$H_2O_2$氧化为$Fe(OH)_3$沉淀,同时有二氧化碳气体生成,“合成”中氢氧化铁、$NaOH$与乙二胺四乙酸反应生成$NaFeY$溶液,经过减压过滤,蒸发浓缩,冷却结晶,过滤,洗涤干燥得到$NaFeY·3H_2O$晶体。
解析:
(3)①由$[Fe_2(OH)_2(H_2O)_8]^{4+}$的结构可知,键1为Fe与O形成的配位键,O原子同时与1个Fe和2个H成键,电子云集中在Fe与O之间,键2中O原子同时与2个Fe和1个H成键,Fe的电负性较小,对O的电子云吸引较弱,O原子周围电子云密度较大,导致对Fe的吸引增强,键长较短,则键长:1>2;②结合$[Fe_2(OH)_2(H_2O)_8]^{4+}$的结构分析,绿矾两步反应制备$Fe(OH)_3$的优点有生成大颗粒的$FeCO_3$沉淀易于分离;$Fe^{3+}$水解生成的阳离子易与水分子形成氢键,生成絮状沉淀,难以洗脱。
(4)①$Fe(OH)_3(s)+H_4Y(aq)+OH^-(aq)=[FeY]^-(aq)+4H_2O(l)$的平衡常数$K'=\frac{c\{[FeY]^-\}}{c(H_4Y)c(OH^-)}=\frac{c\{[FeY]^-\}c(Fe^{3+})c^3(OH^-)c(Y^{4-})}{c(H_4Y)c^4(OH^-)c(Fe^{3+})c(Y^{4-})}=\frac{K_1×K_2×K_3×K×K_{sp}[Fe(OH)_3]×K}{(K_w)^4}=\frac{10^{-2}×10^{-2.7}×10^{-6}×10^{-10.3}×10^{-37.4}×10^{25.1}}{(10^{-14})^4}=10^{22.7}$;当溶液中$c(H_2Y^{2-})=c(HY^-)$时,$c(H^+)=\frac{c(H_2Y^{2-})K_{a2}}{c(HY^-)}=K_{a2}=10^{-2.7}mol·L^{-1}$,$pH=2.7$,当溶液中$c(H_2Y^{2-})=c(HY^-)$时,$c(H^+)=\frac{c(H_2Y^{2-})K_{a3}}{c(HY^{3-})}=K_{a3}=10^{-6}mol·L^{-1}$,$pH=6$,说明pH=5时,溶液中主要存在的形态为$H_2Y^{2-}$,因此未配位的含Y主要微粒为$H_2Y^{2-}$;②$H_4Y$中的C—N键由于N原子电负性较大,电子云偏向N,键极性较强,配位后N原子与$Fe^{3+}$成配位键,电子云向金属离子偏移,导致N原子电负性降低,从而C—N键的电子云分布更均匀,极性减小;③$\frac{n(H_4Y)}{n[Fe(OH)_3]}>1$时,$NaFeY$产率减小的原因为溶液呈酸性,N原子易与$H^+$配位且$COO^-$易与$H^+$结合,降低配位能力。
(5)$H_4Y$微溶于冷水,易溶于热水,冷水洗涤可减少产物损失,酸洗洗涤可能引入杂质,热水则导致产物溶解,故选b。
(6)“滤液1”为$Na_2SO_4$溶液,电解$Na_2SO_4$溶液时$H_2O$在阴极得到电子生成$H_2$和$NaOH$,气体1和气体2为$CO_2$,过量$CO_2$和$NaOH$溶液反应生成碳酸氢钠,可循环用于沉铁步骤。
查看更多完整答案,请扫码查看


