2025年学霸高考黑题化学人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年学霸高考黑题化学人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第10页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
合成NH₃的两条途径如图所示。下列叙述正确的是(

A.NH₃的空间结构为平面三角形,中心原子N的杂化方式为sp²
B.在ER途径中,N₂形成自由基N·,该过程破坏了N₂中的σ键和π键
C.在LH途径中,AuCu₃改变了反应的焓变,提高合成氨的反应速率
D.使用催化剂可以降低ER途径和LH途径中的决速步骤活化能,提高N₂平衡转化率
B
)
A.NH₃的空间结构为平面三角形,中心原子N的杂化方式为sp²
B.在ER途径中,N₂形成自由基N·,该过程破坏了N₂中的σ键和π键
C.在LH途径中,AuCu₃改变了反应的焓变,提高合成氨的反应速率
D.使用催化剂可以降低ER途径和LH途径中的决速步骤活化能,提高N₂平衡转化率
答案:
巩固训练1 B 解析:$\mathrm{NH_3}$中N原子价层电子对数为4,采用$\mathrm{sp^3}$杂化,有一对孤电子,空间结构为三角锥形,A错误;氮分子之间存在非极性键(含σ键和π键),形成自由基N·破坏了$\mathrm{N_2}$中的σ键和π键,B正确;催化剂只改变反应途径,不能改变反应的焓变(反应热),C错误;催化剂可降低决速步骤活化能,提高反应速率,但不能提高$\mathrm{N_2}$平衡转化率,D错误。
以金属镍为催化剂由乙烷制备甲烷,反应过程中的部分反应历程如图所示,下列说法正确的是(
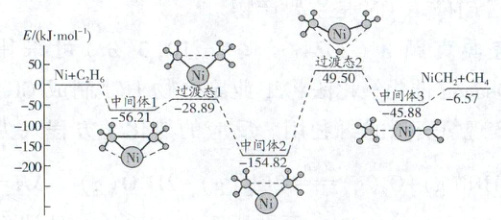
A.总反应为Ni(s)+C₂H₆(g)→NiCH₂(s)+CH₄(g) $\Delta H$>0
B.由中间体2生成中间体3的反应速率影响了总反应的反应速率
C.催化剂镍的使用降低了该反应的活化能,同时也改变了该反应的焓变
D.该反应的过程中既有极性键和非极性的断裂,又有极性键和非极性键的形成
B
)
A.总反应为Ni(s)+C₂H₆(g)→NiCH₂(s)+CH₄(g) $\Delta H$>0
B.由中间体2生成中间体3的反应速率影响了总反应的反应速率
C.催化剂镍的使用降低了该反应的活化能,同时也改变了该反应的焓变
D.该反应的过程中既有极性键和非极性的断裂,又有极性键和非极性键的形成
答案:
巩固训练2 B 解析:从图中可知总反应为放热反应,即焓变小于0,A错误;由图可知,中间体2到过渡态2的能垒最大,为决速步骤,所以由中间体2生成中间体3的反应速率影响了总反应的反应速率,B正确;催化剂只加快反应速率,降低反应活化能,但不改变反应的始态和终态,故不改变反应的焓变,C错误;该反应的过程中有极性键和非极性的断裂,但只有极性键的形成,没有非极性键的形成,D错误。
技巧点拨
能垒式催化机理类历程图
单一反应
(1)基元反应:大多数化学反应要经历多个反应步骤完成,每一步反应称为基元反应。
(2)过渡态理论:反应物分子必须经过形成活化络合物的过渡状态,并达到一定的活化能。这与爬山类似,山的最高点便是过渡态。
(3)多步反应的活化能:每一个基元反应都经历一个过渡态(如图 )。基元反应的活化能越大,反应速率就越慢。最高能垒$E_{a1}$决定了整个步骤的反应速率,称为“控速步”。
)。基元反应的活化能越大,反应速率就越慢。最高能垒$E_{a1}$决定了整个步骤的反应速率,称为“控速步”。
巩固训练2 B 解析:从图中可知总反应为放热反应,即焓变小于0,A错误;由图可知,中间体2到过渡态2的能垒最大,为决速步骤,所以由中间体2生成中间体3的反应速率影响了总反应的反应速率,B正确;催化剂只加快反应速率,降低反应活化能,但不改变反应的始态和终态,故不改变反应的焓变,C错误;该反应的过程中有极性键和非极性的断裂,但只有极性键的形成,没有非极性键的形成,D错误。
技巧点拨
能垒式催化机理类历程图
单一反应
(1)基元反应:大多数化学反应要经历多个反应步骤完成,每一步反应称为基元反应。
(2)过渡态理论:反应物分子必须经过形成活化络合物的过渡状态,并达到一定的活化能。这与爬山类似,山的最高点便是过渡态。
(3)多步反应的活化能:每一个基元反应都经历一个过渡态(如图
 )。基元反应的活化能越大,反应速率就越慢。最高能垒$E_{a1}$决定了整个步骤的反应速率,称为“控速步”。
)。基元反应的活化能越大,反应速率就越慢。最高能垒$E_{a1}$决定了整个步骤的反应速率,称为“控速步”。 某团队合成了一种铁掺杂二氧化钛的新型催化剂,用于转化H₂S为单质S,提出的催化历程示意图如下。Nₐ是阿伏加德罗常数的值。下列说法正确的是(

A.O₂使Fe²⁺转化成Fe³⁺,恢复催化剂活性
B.过程①和④均发生了非极性键的断裂
C.过程②和③均发生了氧化还原反应
D.理论上,每转化34 g H₂S,转移的电子数目为Nₐ
A
)
A.O₂使Fe²⁺转化成Fe³⁺,恢复催化剂活性
B.过程①和④均发生了非极性键的断裂
C.过程②和③均发生了氧化还原反应
D.理论上,每转化34 g H₂S,转移的电子数目为Nₐ
答案:
巩固训练3 A 解析:根据图示③④两步历程,可知$\mathrm{O_2}$使$\mathrm{Fe^{2+}}$转化成$\mathrm{Fe^{3+}}$,恢复催化剂活性,A正确;过程①中没有发生非极性键的断裂,过程④中发生了O=O非极性键的断裂,B错误;过程②中铁元素化合价发生变化,发生氧化还原反应,过程③中元素化合价没有变化,没有发生氧化还原反应,C错误;根据图示,该催化历程的总反应为$\mathrm{2H_2S+O_2\xrightarrow{催化剂}2S+2H_2O}$,可知$\mathrm{H_2S\sim2e^-}$,理论上,每转化34g$\mathrm{H_2S}$即1mol$\mathrm{H_2S}$,转移的电子数目为$2N_A$,D错误。
利用CO₂加氢制CH₃OH的反应机理如图所示。H₂首先在ZnGaO₃催化剂表面解离成2个H*,随后参与到CO₂的还原过程。下列说法错误的是(

已知:□表示氧原子空位,*表示吸附在催化剂上的微粒,Nₐ表示阿伏加德罗常数。
A.反应过程存在C—H、O—H的断裂和形成
B.催化剂氧空位用于捕获CO₂,氧空位越多反应速率越快
C.若反应温度过高使甲醇炭化,生成的碳颗粒易使催化剂反应活性下降
D.理论上,每生成1 mol CH₃OH,该历程中消耗的H*的数目为6Nₐ
A
)
已知:□表示氧原子空位,*表示吸附在催化剂上的微粒,Nₐ表示阿伏加德罗常数。
A.反应过程存在C—H、O—H的断裂和形成
B.催化剂氧空位用于捕获CO₂,氧空位越多反应速率越快
C.若反应温度过高使甲醇炭化,生成的碳颗粒易使催化剂反应活性下降
D.理论上,每生成1 mol CH₃OH,该历程中消耗的H*的数目为6Nₐ
答案:
巩固训练4 A 解析:反应过程存在O—H的形成,但无O—H的断裂,A错误;$\mathrm{H_2}$首先在$\mathrm{ZnGa_2O_3}$催化剂表面解离成2个$\mathrm{H^+}$,2个$\mathrm{H^+}$与催化剂反应形成氧空位,催化剂氧空位再与$\mathrm{CO_2}$结合,所以催化剂氧空位用于捕获$\mathrm{CO_2}$,氧空位越多反应速率越快,B正确;反应温度过高使甲醇炭化,碳覆盖在催化剂的表面,使催化剂反应活性下降,C正确;$\mathrm{H_2}$首先在$\mathrm{ZnGa_2O_3}$催化剂表面解离成2个$\mathrm{H^+}$,随后参与到$\mathrm{CO_2}$的还原过程,根据图中信息可知,$\mathrm{CH_3OH\sim6H^+}$,所以理论上,每生成1mol$\mathrm{CH_3OH}$,该历程中消耗的$\mathrm{H^+}$的数目为$6N_A$,D正确。
查看更多完整答案,请扫码查看


