2025年学霸高考黑题化学人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年学霸高考黑题化学人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第24页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
某兴趣小组利用废铜屑(主要成分为Cu,还含有少量Fe、Fe₂O₃)制备助燃剂——六水合高氯酸铜[Cu(ClO₄)₂·6H₂O],相关的流程如下:

已知:Cu(ClO₄)₂·6H₂O易溶于水,微溶于乙醇,120℃时分解。
(1)步骤Ⅰ,H₂O₂浓度对反应速率有影响。通过如图所示装置将少量稀H₂O₂溶液浓缩,仪器A的名称是,毛细管的作用是平衡气压和,外接真空泵的原因是。
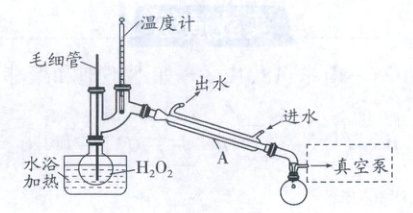
(2)步骤Ⅲ,反应温度控制不超过80℃的原因是。
(3)下列说法正确的是
A. 步骤Ⅰ,H₂O₂的作用仅是将Fe²⁺氧化为Fe³⁺
B. 步骤Ⅱ,滤渣的主要成分为Fe(OH)₃
C. 步骤Ⅲ,为了提高Cu²⁺的转化率,n(NaHCO₃):n(Cu²⁺)>2:1
D. 步骤Ⅳ,沉淀可以先用蒸馏水洗涤,再用无水乙醇洗涤
(4)通过步骤Ⅴ和一系列操作可得到Cu(ClO₄)₂·6H₂O。从下列选项中选择最佳操作并排序:Cu₂(OH)₂CO₃→(
a. 向浓HClO₄一次性加入Cu₂(OH)₂CO₃
b. 向浓HClO₄分几次加入Cu₂(OH)₂CO₃
c. 冷却结晶,蒸发皿底部出现大量晶体
d. 继续蒸发至有晶膜出现
e. 刮下残留在蒸发皿底部的晶体,加水溶解重新蒸发再冷却
f. 在通风橱中蒸发溶液至不再产生酸雾
g. 将固体置于60℃的烘箱中干燥2小时
(5)用“恒电流电解法”测定Cu(ClO₄)₂·6H₂O样品中Cu的含量,步骤如下:
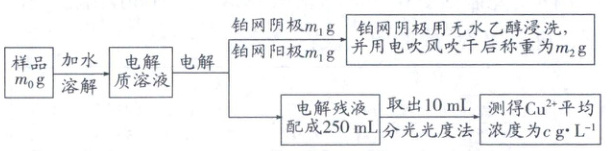
①样品中Cu元素的质量分数是
②若铂网阴极用酒精灯小火进行长时间烘干,样品中Cu元素的质量分数

已知:Cu(ClO₄)₂·6H₂O易溶于水,微溶于乙醇,120℃时分解。
(1)步骤Ⅰ,H₂O₂浓度对反应速率有影响。通过如图所示装置将少量稀H₂O₂溶液浓缩,仪器A的名称是,毛细管的作用是平衡气压和,外接真空泵的原因是。

(2)步骤Ⅲ,反应温度控制不超过80℃的原因是。
(3)下列说法正确的是
BCD
(填字母)。A. 步骤Ⅰ,H₂O₂的作用仅是将Fe²⁺氧化为Fe³⁺
B. 步骤Ⅱ,滤渣的主要成分为Fe(OH)₃
C. 步骤Ⅲ,为了提高Cu²⁺的转化率,n(NaHCO₃):n(Cu²⁺)>2:1
D. 步骤Ⅳ,沉淀可以先用蒸馏水洗涤,再用无水乙醇洗涤
(4)通过步骤Ⅴ和一系列操作可得到Cu(ClO₄)₂·6H₂O。从下列选项中选择最佳操作并排序:Cu₂(OH)₂CO₃→(
b
)→(f
)→d→(c
)→(e
)→g→Cu(ClO₄)₂·6H₂Oa. 向浓HClO₄一次性加入Cu₂(OH)₂CO₃
b. 向浓HClO₄分几次加入Cu₂(OH)₂CO₃
c. 冷却结晶,蒸发皿底部出现大量晶体
d. 继续蒸发至有晶膜出现
e. 刮下残留在蒸发皿底部的晶体,加水溶解重新蒸发再冷却
f. 在通风橱中蒸发溶液至不再产生酸雾
g. 将固体置于60℃的烘箱中干燥2小时
(5)用“恒电流电解法”测定Cu(ClO₄)₂·6H₂O样品中Cu的含量,步骤如下:

①样品中Cu元素的质量分数是
$\frac{25c+100(m₂ - m₁)}{m₀}$
%(用含m₀、m₁、m₂、c的式子表示)。②若铂网阴极用酒精灯小火进行长时间烘干,样品中Cu元素的质量分数
偏大
(填“偏大”“偏小”或“无影响”)。
答案:
(1)直形冷凝管 防止溶液暴沸 减压或抽气,降低水的沸点,减少H₂O₂分解
(2)温度过高,NaHCO₃或Cu₂(OH)₂CO₃受热分解
(3)BCD
(4)b f c e
(5)①$\frac{25c+100(m₂ - m₁)}{m₀}$ ②偏大
解题思路
废铜屑(主要成分为Cu,还含有少量Fe、Fe₂O₃),加入稀硫酸浸取,Fe、Fe₂O₃与稀硫酸反应,铜单质不与硫酸反应,加入双氧水将Fe²⁺氧化为Fe³⁺,同时铜单质与双氧水在酸性条件下反应生成铜离子,所得溶液含有Cu²⁺、Fe³⁺的溶液,调节溶液pH,将Fe³⁺转化为Fe(OH)₃沉淀除去,再加入NaHCO₃过滤后得到主要含有Cu₂(OH)₂CO₃的滤渣,再加入浓HClO₄,得到Cu(ClO₄)₂溶液,再经过一系列操作,最终得到Cu(ClO₄)₂·6H₂O。
解析:
(1)H₂O₂受热易分解,浓缩时需要减压蒸馏,馏出物为H₂O,毛细管提供汽化中心,防止液体暴沸。
(2)NaHCO₃中HCO₃⁻易水解,且NaHCO₃、Cu₂(OH)₂CO₃受热也不稳定。
(3)步骤I,H₂O₂的作用除了是将Fe²⁺氧化为Fe³⁺外,还将Cu氧化为Cu²⁺,A错误;步骤II,通过调节pH将Fe³⁺转为Fe(OH)₃,B正确;步骤III,根据方程式4NaHCO₃+2CuSO₄══Cu₂(OH)₂CO₃↓+2Na₂SO₄+3CO₂↑+H₂O,加入过量的NaHCO₃,可提高Cu²⁺的转化率,C正确;步骤IV,Cu₂(OH)₂CO₃沉淀难溶于水,可以先用蒸馏水洗涤,再用无水乙醇洗涤除去沉淀表面的水分,D正确。
(4)Cu₂(OH)₂CO₃与浓HClO₄反应放热,应向浓HClO₄分几次加入Cu₂(OH)₂CO₃,在通风橱中蒸发溶液至不再产生酸雾,继续蒸发至有晶膜出现,冷却结晶,蒸发皿底部出现大量晶体,刮下残留在蒸发皿底部的晶体,加水溶解重新蒸发再冷却,将固体置于60℃的烘箱中干燥2小时,得到Cu(ClO₄)₂·6H₂O,故顺序是:b→f→c→e→Cu(ClO₄)₂·6H₂O。
(5)①由实验原理可知,m(Cu)=铂网阴极析出的铜+电解残液中的铜,即样品中m(Cu)=(m₂ - m₁)g+250×10⁻³L×c g·L⁻¹,样品中Cu元素的质量分数是$\frac{[(m₂ - m₁)+250×10⁻³×c]g}{m₀ g}$×100% = $\frac{25c+100(m₂ - m₁)}{m₀}$%;②若铂网阴极用酒精灯小火进行长时间烘干,导致铜片被氧化,Cu的质量增加,测得样品中Cu元素的质量分数偏大。
(1)直形冷凝管 防止溶液暴沸 减压或抽气,降低水的沸点,减少H₂O₂分解
(2)温度过高,NaHCO₃或Cu₂(OH)₂CO₃受热分解
(3)BCD
(4)b f c e
(5)①$\frac{25c+100(m₂ - m₁)}{m₀}$ ②偏大
解题思路
废铜屑(主要成分为Cu,还含有少量Fe、Fe₂O₃),加入稀硫酸浸取,Fe、Fe₂O₃与稀硫酸反应,铜单质不与硫酸反应,加入双氧水将Fe²⁺氧化为Fe³⁺,同时铜单质与双氧水在酸性条件下反应生成铜离子,所得溶液含有Cu²⁺、Fe³⁺的溶液,调节溶液pH,将Fe³⁺转化为Fe(OH)₃沉淀除去,再加入NaHCO₃过滤后得到主要含有Cu₂(OH)₂CO₃的滤渣,再加入浓HClO₄,得到Cu(ClO₄)₂溶液,再经过一系列操作,最终得到Cu(ClO₄)₂·6H₂O。
解析:
(1)H₂O₂受热易分解,浓缩时需要减压蒸馏,馏出物为H₂O,毛细管提供汽化中心,防止液体暴沸。
(2)NaHCO₃中HCO₃⁻易水解,且NaHCO₃、Cu₂(OH)₂CO₃受热也不稳定。
(3)步骤I,H₂O₂的作用除了是将Fe²⁺氧化为Fe³⁺外,还将Cu氧化为Cu²⁺,A错误;步骤II,通过调节pH将Fe³⁺转为Fe(OH)₃,B正确;步骤III,根据方程式4NaHCO₃+2CuSO₄══Cu₂(OH)₂CO₃↓+2Na₂SO₄+3CO₂↑+H₂O,加入过量的NaHCO₃,可提高Cu²⁺的转化率,C正确;步骤IV,Cu₂(OH)₂CO₃沉淀难溶于水,可以先用蒸馏水洗涤,再用无水乙醇洗涤除去沉淀表面的水分,D正确。
(4)Cu₂(OH)₂CO₃与浓HClO₄反应放热,应向浓HClO₄分几次加入Cu₂(OH)₂CO₃,在通风橱中蒸发溶液至不再产生酸雾,继续蒸发至有晶膜出现,冷却结晶,蒸发皿底部出现大量晶体,刮下残留在蒸发皿底部的晶体,加水溶解重新蒸发再冷却,将固体置于60℃的烘箱中干燥2小时,得到Cu(ClO₄)₂·6H₂O,故顺序是:b→f→c→e→Cu(ClO₄)₂·6H₂O。
(5)①由实验原理可知,m(Cu)=铂网阴极析出的铜+电解残液中的铜,即样品中m(Cu)=(m₂ - m₁)g+250×10⁻³L×c g·L⁻¹,样品中Cu元素的质量分数是$\frac{[(m₂ - m₁)+250×10⁻³×c]g}{m₀ g}$×100% = $\frac{25c+100(m₂ - m₁)}{m₀}$%;②若铂网阴极用酒精灯小火进行长时间烘干,导致铜片被氧化,Cu的质量增加,测得样品中Cu元素的质量分数偏大。
查看更多完整答案,请扫码查看


