2025年学霸高考黑题化学人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年学霸高考黑题化学人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第86页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
经典真题 1 盖斯定律计算反应热类
(2025·甘肃,17 题节选)乙炔加氢是除去乙烯中少量乙炔杂质,得到高纯度乙烯的重要方法。该过程包括以下两个主要反应:
反应 1:C₂H₂(g) + H₂(g) = C₂H₄(g) ΔH₁ = -175 kJ·mol⁻¹(25℃,101 kPa)
反应 2:C₂H₂(g) + 2H₂(g) = C₂H₆(g) ΔH₂ = -312 kJ·mol⁻¹(25℃,101 kPa)
(1)25℃,101 kPa 时,反应 C₂H₄(g) + H₂(g) = C₂H₆(g) ΔH =
(2)以 Pd/W 或 Pd 为催化剂,可在常温常压(25℃,101 kPa)下实现乙炔加氢,反应机理如下图所示(虚线为生成乙烷的路径)。以

(2025·甘肃,17 题节选)乙炔加氢是除去乙烯中少量乙炔杂质,得到高纯度乙烯的重要方法。该过程包括以下两个主要反应:
反应 1:C₂H₂(g) + H₂(g) = C₂H₄(g) ΔH₁ = -175 kJ·mol⁻¹(25℃,101 kPa)
反应 2:C₂H₂(g) + 2H₂(g) = C₂H₆(g) ΔH₂ = -312 kJ·mol⁻¹(25℃,101 kPa)
(1)25℃,101 kPa 时,反应 C₂H₄(g) + H₂(g) = C₂H₆(g) ΔH =
-137
kJ·mol⁻¹。(2)以 Pd/W 或 Pd 为催化剂,可在常温常压(25℃,101 kPa)下实现乙炔加氢,反应机理如下图所示(虚线为生成乙烷的路径)。以
Pd/W
为催化剂时,乙烯的选择性更高,原因Pd/W作催化剂时,生成乙烷的活化能大于Pd作催化剂时的
。(图中“*”表示吸附态;数值为生成相应过渡态的活化能)
答案:
经典真题1(1)-137(2)Pd/W Pd/W作催化剂时,生成乙烷的活化能大于Pd作催化剂时的
解题思路
第一步——对比
目标反应式:C₂H₄(g)+H₂(g)=C₂H₆(g)
已知反应式:①C₂H₂(g)+H₂(g)=C₂H₄(g)ΔH₁=-175kJ·mol⁻¹(25℃,101kPa)
②C₂H₂(g)+2H₂(g)=C₂H₆(g)ΔH₂=-312kJ·mol⁻¹(25℃,101kPa)
目标反应式的反应物与①中的生成物相近,生成物与②中的生成物相同,发现目标反应式可通过两个反应式相减得到。
第二步——叠加
知道目标反应式可由已知反应式相减得到,那么合并两个已知反应式②-①得到:C₂H₄(g)+H₂(g)=C₂H₆(g),与目标反应式一致。
第三步——计算
化学反应的反应热只与反应体系的始态和终态有关,与反应的途径无关,根据第二步可知,目标反应式=反应②-反应①,故而反应热
ΔH=ΔH₂-ΔH₁=-312kJ·mol⁻¹+175kJ·mol⁻¹=-137kJ·mol⁻¹。
解析:
(1)由盖斯定律,②-①可以得到目标反应,则ΔH=ΔH₂-ΔH₁=-312kJ·mol⁻¹+175kJ·mol⁻¹=-137kJ·mol⁻¹。
(2)由题图可知,选择Pd作催化剂时,生成乙烷的活化能低于选择Pd/W作催化剂时的(0.68<0.83),说明使用Pd作催化剂,乙烯更容易转化为乙烷,使乙烯的选择性更小,故Pd/W作催化剂时,乙烯的选择性更高。
解题思路
第一步——对比
目标反应式:C₂H₄(g)+H₂(g)=C₂H₆(g)
已知反应式:①C₂H₂(g)+H₂(g)=C₂H₄(g)ΔH₁=-175kJ·mol⁻¹(25℃,101kPa)
②C₂H₂(g)+2H₂(g)=C₂H₆(g)ΔH₂=-312kJ·mol⁻¹(25℃,101kPa)
目标反应式的反应物与①中的生成物相近,生成物与②中的生成物相同,发现目标反应式可通过两个反应式相减得到。
第二步——叠加
知道目标反应式可由已知反应式相减得到,那么合并两个已知反应式②-①得到:C₂H₄(g)+H₂(g)=C₂H₆(g),与目标反应式一致。
第三步——计算
化学反应的反应热只与反应体系的始态和终态有关,与反应的途径无关,根据第二步可知,目标反应式=反应②-反应①,故而反应热
ΔH=ΔH₂-ΔH₁=-312kJ·mol⁻¹+175kJ·mol⁻¹=-137kJ·mol⁻¹。
解析:
(1)由盖斯定律,②-①可以得到目标反应,则ΔH=ΔH₂-ΔH₁=-312kJ·mol⁻¹+175kJ·mol⁻¹=-137kJ·mol⁻¹。
(2)由题图可知,选择Pd作催化剂时,生成乙烷的活化能低于选择Pd/W作催化剂时的(0.68<0.83),说明使用Pd作催化剂,乙烯更容易转化为乙烷,使乙烯的选择性更小,故Pd/W作催化剂时,乙烯的选择性更高。
经典真题 2 键能计算反应热类
(2025·黑吉辽蒙,18 题节选)乙二醇是一种重要化工原料,以合成气(CO、H₂)为原料合成乙二醇具有重要意义。
直接合成法:2CO(g) + 3H₂(g) ⇌ HOCH₂CH₂OH(g),不同温度下平衡常数如下表所示。

(1)该反应的 ΔH
(2)已知 CO(g)、H₂(g)、HOCH₂CH₂OH(g)的燃烧热(ΔH)分别为 -a kJ·mol⁻¹、-b kJ·mol⁻¹、-c kJ·mol⁻¹,则上述合成反应的 ΔH =
(2025·黑吉辽蒙,18 题节选)乙二醇是一种重要化工原料,以合成气(CO、H₂)为原料合成乙二醇具有重要意义。
直接合成法:2CO(g) + 3H₂(g) ⇌ HOCH₂CH₂OH(g),不同温度下平衡常数如下表所示。

(1)该反应的 ΔH
<
0(填“>”或“<”)。(2)已知 CO(g)、H₂(g)、HOCH₂CH₂OH(g)的燃烧热(ΔH)分别为 -a kJ·mol⁻¹、-b kJ·mol⁻¹、-c kJ·mol⁻¹,则上述合成反应的 ΔH =
-2a-3b+c(或c-2a-3b)
kJ·mol⁻¹(用 a、b 和 c 表示)。
答案:
经典真题2(1)<(2)-2a-3b+c(或c-2a-3b)
解题思路
根据反应热=反应物的总键能-生成物的总键能计算。
解析:
(1)根据表格中的数据,反应温度升高反应的平衡常数减小,说明反应向逆反应方向移动,又因升高温度向吸热反应方向移动,故逆反应为吸热反应,正反应为放热反应,该反应的ΔH<0。
(2)根据已知条件可以写出如下热化学方程式:①CO(g)+1/2O₂(g)=CO₂(g)ΔH₁=-akJ·mol⁻¹;②H₂(g)+1/2O₂(g)=H₂O(l)ΔH₂=-bkJ·mol⁻¹;③HOCH₂CH₂OH(g)+5/2O₂(g)=2CO₂(g)+3H₂O(l)ΔH₃=-ckJ·mol⁻¹;根据盖斯定律,2×①+3×②-③即可得到目标方程式,故目标方程式的ΔH=(c-2a-3b)kJ·mol⁻¹。
解题思路
根据反应热=反应物的总键能-生成物的总键能计算。
解析:
(1)根据表格中的数据,反应温度升高反应的平衡常数减小,说明反应向逆反应方向移动,又因升高温度向吸热反应方向移动,故逆反应为吸热反应,正反应为放热反应,该反应的ΔH<0。
(2)根据已知条件可以写出如下热化学方程式:①CO(g)+1/2O₂(g)=CO₂(g)ΔH₁=-akJ·mol⁻¹;②H₂(g)+1/2O₂(g)=H₂O(l)ΔH₂=-bkJ·mol⁻¹;③HOCH₂CH₂OH(g)+5/2O₂(g)=2CO₂(g)+3H₂O(l)ΔH₃=-ckJ·mol⁻¹;根据盖斯定律,2×①+3×②-③即可得到目标方程式,故目标方程式的ΔH=(c-2a-3b)kJ·mol⁻¹。
经典真题 3 反应热判断类
(2021·全国乙,28 题节选)一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:
McMorris 测定和计算了在 136~180℃范围内下列反应的平衡常数 Kₚ:
2NO(g) + 2ICl(g) ⇌ 2NOCl(g) + I₂(g) Kₚ₁
2NOCl(g) ⇌ 2NO(g) + Cl₂(g) Kₚ₂
得到 lg Kₚ₁ ~ 1/T 和 lg Kₚ₂ ~ 1/T 均为线性关系,如下图所示:
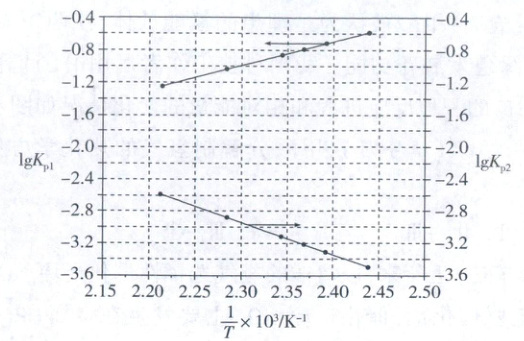
(1)由图可知,NOCl 分解为 NO 和 Cl₂反应的 ΔH
(2)反应 2ICl(g) = Cl₂(g) + I₂(g) 的 K =
(2021·全国乙,28 题节选)一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:
McMorris 测定和计算了在 136~180℃范围内下列反应的平衡常数 Kₚ:
2NO(g) + 2ICl(g) ⇌ 2NOCl(g) + I₂(g) Kₚ₁
2NOCl(g) ⇌ 2NO(g) + Cl₂(g) Kₚ₂
得到 lg Kₚ₁ ~ 1/T 和 lg Kₚ₂ ~ 1/T 均为线性关系,如下图所示:

(1)由图可知,NOCl 分解为 NO 和 Cl₂反应的 ΔH
大于
0(填“大于”或“小于”)。(2)反应 2ICl(g) = Cl₂(g) + I₂(g) 的 K =
Kₚ₁·Kₚ₂
(用 Kₚ₁、Kₚ₂表示);该反应的 ΔH大于
0(填“大于”或“小于”),写出推理过程:设T'>T,即1/T'<1/T,由图可知:lgKₚ₂(T')-lgKₚ₂(T)>lgKₚ₁(T')-lgKₚ₁(T)=lgKₚ₁(T)-lgKₚ₁(T'),则lg[Kₚ₂(T')·Kₚ₁(T')]>lg[Kₚ₂(T)·Kₚ₁(T)],即K(T')>K(T),因此该反应正反应为吸热反应,即ΔH大于0
。
答案:
经典真题3(1)大于(2)Kₚ₁·Kₚ₂ 大于 设T'>T,即1/T'<1/T,由图可知:lgKₚ₂(T')-lgKₚ₂(T)>lgKₚ₁(T')-lgKₚ₁(T)=lgKₚ₁(T)-lgKₚ₁(T'),则lg[Kₚ₂(T')·Kₚ₁(T')]>lg[Kₚ₂(T)·Kₚ₁(T)],即K(T')>K(T),因此该反应正反应为吸热反应,即ΔH大于0

解题思路
由图像:①1/T增大,温度降低,lgKₚ₁逐渐增大,即Kₚ₁逐渐增大;lgKₚ₂逐渐减小,即Kₚ₂逐渐减小。②由两条直线倾斜程度可知,改变温度对lgKₚ₂的影响程度大于对lgKₚ₁的影响程度。
经典真题3(1)大于(2)Kₚ₁·Kₚ₂ 大于 设T'>T,即1/T'<1/T,由图可知:lgKₚ₂(T')-lgKₚ₂(T)>lgKₚ₁(T')-lgKₚ₁(T)=lgKₚ₁(T)-lgKₚ₁(T'),则lg[Kₚ₂(T')·Kₚ₁(T')]>lg[Kₚ₂(T)·Kₚ₁(T)],即K(T')>K(T),因此该反应正反应为吸热反应,即ΔH大于0

解题思路
由图像:①1/T增大,温度降低,lgKₚ₁逐渐增大,即Kₚ₁逐渐增大;lgKₚ₂逐渐减小,即Kₚ₂逐渐减小。②由两条直线倾斜程度可知,改变温度对lgKₚ₂的影响程度大于对lgKₚ₁的影响程度。
查看更多完整答案,请扫码查看


