2025年全优课堂九年级化学下册
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年全优课堂九年级化学下册 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第89页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
9. 阳台无土栽培蔬菜的营养液配方主要成分有:Ca(NO₃)₂、K₂SO₄、KH₂PO₄、MgSO₄、(NH₄)₂SO₄。阅读上述信息后回答下列问题。
(1)分析营养液配方,绿叶菜生长需要的主要营养元素有________________(填元素符号)。
(2)营养液配方中属于复合肥料的是________(填化学式)。
(1)分析营养液配方,绿叶菜生长需要的主要营养元素有________________(填元素符号)。
(2)营养液配方中属于复合肥料的是________(填化学式)。
答案:
(1)N、P、K
(2)KH₂PO₄
(1)N、P、K
(2)KH₂PO₄
10. 质检人员义务为农民检测以下化肥:碳铵、氯化铵、过磷酸钙、氯化钾、硫酸钾。若你是检验组中的一员,请参加以下探究。
(1)观察外观,颜色为灰白色的化肥是______。
(2)在白色化肥中能闻到明显气味的是____。
(3)对没有区分开的白色化肥分别加入熟石灰粉末,进行研磨,有氨味的是__________。
(4)上述化肥中,对氯化物和硫酸盐,检验它们时,先向其溶液中加____________。
(1)观察外观,颜色为灰白色的化肥是______。
(2)在白色化肥中能闻到明显气味的是____。
(3)对没有区分开的白色化肥分别加入熟石灰粉末,进行研磨,有氨味的是__________。
(4)上述化肥中,对氯化物和硫酸盐,检验它们时,先向其溶液中加____________。
答案:
(1)过磷酸钙
(2)碳铵
(3)氯化铵
(4)Ba(NO₃)₂溶液
提示:
(1)磷肥为灰白色粉状固体,过磷酸钙含有氮、磷、钾三种元素中的磷元素,属于磷肥;碳铵、氯化铵、氯化钾、硫酸钾均为白色晶体;
(2)碳铵易分解产生有刺激性气味的气体,故白色化肥中能闻到明显气味的是碳铵;
(3)氯化铵属于铵态氮肥,铵态氮肥能与熟石灰反应放出有刺激性气味的氨气;
(4)检验Cl⁻和SO₄²⁻时,若先检验Cl⁻,需加入硝酸银溶液,银离子也会与硫酸根离子反应,生成硫酸银微溶物,对SO₄²⁻的检验产生干扰,所以应先检验SO₄²⁻,即加入硝酸钡溶液,若有白色沉淀(硫酸钡)生成,则是硫酸钾,无明显变化的则是氯化物。
(1)过磷酸钙
(2)碳铵
(3)氯化铵
(4)Ba(NO₃)₂溶液
提示:
(1)磷肥为灰白色粉状固体,过磷酸钙含有氮、磷、钾三种元素中的磷元素,属于磷肥;碳铵、氯化铵、氯化钾、硫酸钾均为白色晶体;
(2)碳铵易分解产生有刺激性气味的气体,故白色化肥中能闻到明显气味的是碳铵;
(3)氯化铵属于铵态氮肥,铵态氮肥能与熟石灰反应放出有刺激性气味的氨气;
(4)检验Cl⁻和SO₄²⁻时,若先检验Cl⁻,需加入硝酸银溶液,银离子也会与硫酸根离子反应,生成硫酸银微溶物,对SO₄²⁻的检验产生干扰,所以应先检验SO₄²⁻,即加入硝酸钡溶液,若有白色沉淀(硫酸钡)生成,则是硫酸钾,无明显变化的则是氯化物。
11. 某化学兴趣小组的同学为了探究“复分解反应发生的条件”,做了两个实验:CuSO₄溶液分别与NaOH溶液、BaCl₂溶液反应。实验结束后将两实验中的废液倒入同一个干净的烧杯中,充分混合后过滤,得到滤液呈无色。
(1)写出废液混合后使滤液变无色时一定发生的反应的化学方程式:____________________。
(2)取少量滤液于试管中,滴入紫色石蕊溶液,石蕊溶液仍为紫色,则滤液呈__________(选填“酸”“中”或“碱”)性。
(3)该小组的同学对滤液中溶质的成分继续进行了如下探究实验:
[提出问题]滤液中溶质的成分是什么?
[作出猜想]猜想I:____________;猜想II:______________;猜想III:______________。
[实验探究]

在实验②的溶液中滴加无色酚酞溶液,观察到酚酞溶液变成红色。
(1)写出废液混合后使滤液变无色时一定发生的反应的化学方程式:____________________。
(2)取少量滤液于试管中,滴入紫色石蕊溶液,石蕊溶液仍为紫色,则滤液呈__________(选填“酸”“中”或“碱”)性。
(3)该小组的同学对滤液中溶质的成分继续进行了如下探究实验:
[提出问题]滤液中溶质的成分是什么?
[作出猜想]猜想I:____________;猜想II:______________;猜想III:______________。
[实验探究]

在实验②的溶液中滴加无色酚酞溶液,观察到酚酞溶液变成红色。
答案:
(1)CuCl₂ + 2NaOH = Cu(OH)₂↓ + 2NaCl
提示:CuSO₄溶液与NaOH溶液反应生成氢氧化铜沉淀和硫酸钠溶液,CuSO₄溶液与BaCl₂溶液反应生成硫酸钡沉淀和氯化铜,所以反应后的废液中一定有氯化铜和硫酸钠。废液混合过滤后所得的滤液为无色,说明滤液中不含铜离子,所以第一个反应中NaOH溶液是过量的,即一定发生的反应是过量的氢氧化钠溶液与氯化铜溶液反应生成氢氧化铜沉淀和氯化钠。
(2)中
(3)[作出猜想]NaCl 、NaCl、BaCl₂ 、NaCl、Na₂SO₄
[实验探究]取少量滤液于试管中,加入适量的氢氧化钡溶液,振荡
提示:滤液最终呈无色,说明溶液中一定不含铜离子。滤液呈中性,说明氢氧化钠与氯化铜恰好完全反应,生成氯化钠。第一个反应生成硫酸钠溶液,若第二个反应中氯化钡溶液恰好反应完,无剩余,那么所得滤液中的溶质是氯化钠和硫酸钠;若第二个反应中氯化钡过量,且过量的氯化钡与第一个反应生成的硫酸钠恰好完全反应,则滤液中的溶质为氯化钠;若过量的氯化钡与第一个反应生成的硫酸钠反应后仍有剩余,则滤液中的溶质为氯化钠和氯化钡。实验①中,加入适量的纯碱溶液后无现象,说明滤液中无钡离子,则猜想II是NaCl、BaCl₂;加入某物质能产生白色沉淀且最后溶液能使酚酞溶液变红,说明加入的是碱性溶液,能与碱性溶液反应生成沉淀的是硫酸钠溶液,碱性溶液与氯化钠溶液不反应,所以碱性溶液为Ba(OH)₂,猜想III是NaCl、Na₂SO₄,猜想I是NaCl。
(1)CuCl₂ + 2NaOH = Cu(OH)₂↓ + 2NaCl
提示:CuSO₄溶液与NaOH溶液反应生成氢氧化铜沉淀和硫酸钠溶液,CuSO₄溶液与BaCl₂溶液反应生成硫酸钡沉淀和氯化铜,所以反应后的废液中一定有氯化铜和硫酸钠。废液混合过滤后所得的滤液为无色,说明滤液中不含铜离子,所以第一个反应中NaOH溶液是过量的,即一定发生的反应是过量的氢氧化钠溶液与氯化铜溶液反应生成氢氧化铜沉淀和氯化钠。
(2)中
(3)[作出猜想]NaCl 、NaCl、BaCl₂ 、NaCl、Na₂SO₄
[实验探究]取少量滤液于试管中,加入适量的氢氧化钡溶液,振荡
提示:滤液最终呈无色,说明溶液中一定不含铜离子。滤液呈中性,说明氢氧化钠与氯化铜恰好完全反应,生成氯化钠。第一个反应生成硫酸钠溶液,若第二个反应中氯化钡溶液恰好反应完,无剩余,那么所得滤液中的溶质是氯化钠和硫酸钠;若第二个反应中氯化钡过量,且过量的氯化钡与第一个反应生成的硫酸钠恰好完全反应,则滤液中的溶质为氯化钠;若过量的氯化钡与第一个反应生成的硫酸钠反应后仍有剩余,则滤液中的溶质为氯化钠和氯化钡。实验①中,加入适量的纯碱溶液后无现象,说明滤液中无钡离子,则猜想II是NaCl、BaCl₂;加入某物质能产生白色沉淀且最后溶液能使酚酞溶液变红,说明加入的是碱性溶液,能与碱性溶液反应生成沉淀的是硫酸钠溶液,碱性溶液与氯化钠溶液不反应,所以碱性溶液为Ba(OH)₂,猜想III是NaCl、Na₂SO₄,猜想I是NaCl。
12. (限时4分钟)向160g硫酸铜溶液中,逐滴加入40gNaOH溶液,恰好完全反应,生成4.9g沉淀,回答下列问题。
(1)恰好完全反应时,溶液的质量为______g
(2)求原硫酸铜溶液中溶质的质量分数。
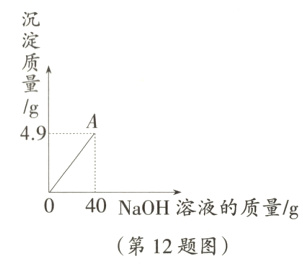
(1)恰好完全反应时,溶液的质量为______g
(2)求原硫酸铜溶液中溶质的质量分数。

答案:
(1)195.1
(2)解:设参加反应的硫酸铜的质量为x。
CuSO₄ + 2NaOH = Cu(OH)₂↓ + Na₂SO₄
160 98
x 4.9g
$\frac{160}{98}$ = $\frac{x}{4.9g}$
x = 8g
原硫酸铜溶液中溶质的质量分数为$\frac{8g}{160g}$×100% = 5%
答:原硫酸铜溶液中溶质的质量分数为5%
(1)195.1
(2)解:设参加反应的硫酸铜的质量为x。
CuSO₄ + 2NaOH = Cu(OH)₂↓ + Na₂SO₄
160 98
x 4.9g
$\frac{160}{98}$ = $\frac{x}{4.9g}$
x = 8g
原硫酸铜溶液中溶质的质量分数为$\frac{8g}{160g}$×100% = 5%
答:原硫酸铜溶液中溶质的质量分数为5%
查看更多完整答案,请扫码查看


