2025年全优课堂九年级化学下册
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年全优课堂九年级化学下册 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第70页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
11. 某种消化药片的有效成分是氢氧化镁,能减缓因胃酸过多引起的疼痛。在氢氧化镁与胃酸作用的过程中,胃液pH变化的情况是( )
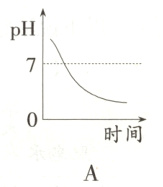
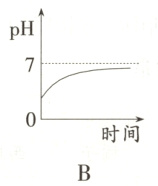
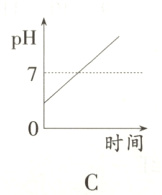
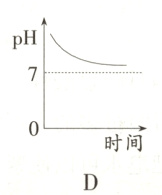




答案:
B 提示:胃液中含有盐酸,所以胃液的pH小于7,当服用含有氢氧化镁的药片后胃液中的盐酸要和氢氧化镁反应,所以溶液的pH值要增大,但是由于服用的药片是适量的,因为在酸性的环境中利于食物的消化,所以只中和一部分盐酸,故胃液的pH值依然小于7,故B项正确。
12. 将下列物质的序号填入适当的空格中:
①石灰石;②氢氧化铝;③消石灰;④稀盐酸;⑤氢氧化钠;⑥氢气。
(1)在农业上常用来改良酸性土壤的是______。
(2)可用于金属表面除锈的是______。
(3)理想的高能燃料是______。
(4)常用于实验室制二氧化碳的是______。
(5)用来治疗胃酸过多的是______。
(6)可用于制肥皂的是______。
①石灰石;②氢氧化铝;③消石灰;④稀盐酸;⑤氢氧化钠;⑥氢气。
(1)在农业上常用来改良酸性土壤的是______。
(2)可用于金属表面除锈的是______。
(3)理想的高能燃料是______。
(4)常用于实验室制二氧化碳的是______。
(5)用来治疗胃酸过多的是______。
(6)可用于制肥皂的是______。
答案:
(1)④
(2)③
(3)⑥
(4)①④
(5)②
(6)⑤
(1)④
(2)③
(3)⑥
(4)①④
(5)②
(6)⑤
13. 向盛有10mLNaOH溶液(其中滴有少量无色酚酞溶液)的烧杯中逐滴加入稀盐酸,用pH计(用来精确测定溶液pH的仪器)测定溶液的pH,所得数据如下:

(1)当加入稀盐酸的体积为______mL时,NaOH溶液和稀盐酸恰好完全反应。
(2)当加入稀盐酸的体积为3mL时,溶液显______色;当加入稀盐酸的体积为14mL时,溶液显______色。
(3)当烧杯中溶液的pH = 2.1时,溶液中的溶质有______________。

(1)当加入稀盐酸的体积为______mL时,NaOH溶液和稀盐酸恰好完全反应。
(2)当加入稀盐酸的体积为3mL时,溶液显______色;当加入稀盐酸的体积为14mL时,溶液显______色。
(3)当烧杯中溶液的pH = 2.1时,溶液中的溶质有______________。
答案:
(1)10
(2)红 无
(3)NaCl和HCl
提示:
(1)pH = 7时,氢氧化钠和稀盐酸恰好完全反应,由表格数据可知,此时消耗的稀盐酸的体积为10mL;
(2)无色酚酞遇碱性溶液变红色,遇酸性和中性溶液不变色;当加入稀盐酸的体积为3mL时,烧杯中溶液的pH大于7,溶液显碱性,能使无色酚酞溶液变红;当加入稀盐酸的体积为14mL时,烧杯中溶液的pH小于7,溶液显酸性,无色酚酞溶液不变色;
(3)当pH = 2.1时,稀盐酸过量,这时溶液中的溶质既有生成的氯化钠,又有未反应的盐酸。
(1)10
(2)红 无
(3)NaCl和HCl
提示:
(1)pH = 7时,氢氧化钠和稀盐酸恰好完全反应,由表格数据可知,此时消耗的稀盐酸的体积为10mL;
(2)无色酚酞遇碱性溶液变红色,遇酸性和中性溶液不变色;当加入稀盐酸的体积为3mL时,烧杯中溶液的pH大于7,溶液显碱性,能使无色酚酞溶液变红;当加入稀盐酸的体积为14mL时,烧杯中溶液的pH小于7,溶液显酸性,无色酚酞溶液不变色;
(3)当pH = 2.1时,稀盐酸过量,这时溶液中的溶质既有生成的氯化钠,又有未反应的盐酸。
14. 现有A、B、C、D、E五种物质,分别为盐酸、硫酸铜、氢氧化钙、铁粉和氧化钙中的一种。其中,A的浓溶液是无色液体,有刺激性气味,在空气中会形成白雾;B为单质;D是配制“波尔多液”的主要成分之一;E是熟石灰的主要成分。(已知硫酸铜能够与氢氧化钙反应生成氢氧化铜沉淀)。请回答下列问题。
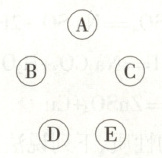
(1)写出C、D两种物质的化学式:
C______,D______。
(2)在图中将能相互反应的物质之间用短线“−−”连线,通过一步反应能直接转化的两种物质之间用箭号“→”连线(从反应物指向生成物)。

(1)写出C、D两种物质的化学式:
C______,D______。
(2)在图中将能相互反应的物质之间用短线“−−”连线,通过一步反应能直接转化的两种物质之间用箭号“→”连线(从反应物指向生成物)。
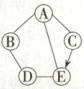
答案:
(1)CaO、CuSO₄
(2)
提示:
(1)由A的浓溶液是无色液体,有刺激性气味,在空气中会形成白雾,可知A是盐酸;B为单质,所以B是铁粉;D是配制“波尔多液”的主要成分之一,E是熟石灰的主要成分,所以D是硫酸铜,E是氢氧化钙,则C是氧化钙。故C、D两种物质的化学式为CaO、CuSO₄;
(2)根据物质间的反应规律可知盐酸能够与铁、氧化钙和氢氧化钙反应。铁能够与盐酸和硫酸铜反应。氧化钙和水反应能够生成氢氧化钙,硫酸铜还能够与氢氧化钙反应。
(1)CaO、CuSO₄
(2)

提示:
(1)由A的浓溶液是无色液体,有刺激性气味,在空气中会形成白雾,可知A是盐酸;B为单质,所以B是铁粉;D是配制“波尔多液”的主要成分之一,E是熟石灰的主要成分,所以D是硫酸铜,E是氢氧化钙,则C是氧化钙。故C、D两种物质的化学式为CaO、CuSO₄;
(2)根据物质间的反应规律可知盐酸能够与铁、氧化钙和氢氧化钙反应。铁能够与盐酸和硫酸铜反应。氧化钙和水反应能够生成氢氧化钙,硫酸铜还能够与氢氧化钙反应。
15. 实验小组研究盐酸、氢氧化钙两种物质的化学性质,做了如图所示实验。

(1)实验后某试管中为黄色溶液,该试管中发生反应的化学方程式为__________________。
(2)实验后某试管中为红色溶液,向其中加入足量的______,溶液变为无色。由此推断,该试管中最初盛有的物质是____________。
(3)实验后某试管的底部有白色固体,过滤后向固体滴加稀盐酸,有气泡出现。由此推断,该试管中最初发生反应的化学方程式为__________________。
(4)实验时某试管中始终无明显变化,向其中滴加数滴酚酞溶液,仍无明显现象。由此推断,该试管中最初发生反应的化学方程式为__________________,最后所得无色溶液中的溶质除了酚酞一定有____________,可能有____________。

(1)实验后某试管中为黄色溶液,该试管中发生反应的化学方程式为__________________。
(2)实验后某试管中为红色溶液,向其中加入足量的______,溶液变为无色。由此推断,该试管中最初盛有的物质是____________。
(3)实验后某试管的底部有白色固体,过滤后向固体滴加稀盐酸,有气泡出现。由此推断,该试管中最初发生反应的化学方程式为__________________。
(4)实验时某试管中始终无明显变化,向其中滴加数滴酚酞溶液,仍无明显现象。由此推断,该试管中最初发生反应的化学方程式为__________________,最后所得无色溶液中的溶质除了酚酞一定有____________,可能有____________。
答案:
(1)Fe₂O₃ + 6HCl = 2FeCl₃ + 3H₂O
(2)稀盐酸(合理即可)、无色酚酞溶液
(3)CO₂ + Ca(OH)₂ = CaCO₃↓ + H₂O
(4)Ca(OH)₂ + 2HCl = CaCl₂ + 2H₂O
CaCl₂、HCl
提示:
(1)实验后某试管中为黄色溶液,该溶液是氯化铁溶液,氯化铁是由氧化铁和稀盐酸反应生成的,氧化铁和稀盐酸反应的化学方程式为Fe₂O₃ + 6HCl = 2FeCl₃ + 3H₂O;
(2)稀盐酸显酸性,能使石蕊溶液变红色,如果向变红色的石蕊溶液中加入过量的显碱性的溶液时,溶液由红色变成蓝色;澄清石灰水显碱性,能使酚酞溶液变红色,如果向变红色的酚酞溶液中加入过量的稀盐酸时,溶液由红色变成无色,因此实验后某试管中为红色溶液,可向其中加入足量的稀盐酸,溶液变为无色,由此推断,该试管中最初盛有的物质是无色酚酞溶液;
(3)二氧化碳通入澄清石灰水中时,二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,稀盐酸和碳酸钙反应生成二氧化碳、氯化钙和水,因此过滤后向固体中滴加稀盐酸,一段时间后有气泡出现,该试管中最初发生反应的化学方程式为CO₂ + Ca(OH)₂ = CaCO₃↓ + H₂O;
(4)实验时某试管中始终无明显变化,图中只有氢氧化钙和稀盐酸反应没有现象,化学方程式为Ca(OH)₂ + 2HCl = CaCl₂ + 2H₂O;向其中滴加数滴酚酞溶液,仍无明显现象,说明溶液显中性或盐酸过量,所以一定有氯化钙,可能有盐酸。
(1)Fe₂O₃ + 6HCl = 2FeCl₃ + 3H₂O
(2)稀盐酸(合理即可)、无色酚酞溶液
(3)CO₂ + Ca(OH)₂ = CaCO₃↓ + H₂O
(4)Ca(OH)₂ + 2HCl = CaCl₂ + 2H₂O
CaCl₂、HCl
提示:
(1)实验后某试管中为黄色溶液,该溶液是氯化铁溶液,氯化铁是由氧化铁和稀盐酸反应生成的,氧化铁和稀盐酸反应的化学方程式为Fe₂O₃ + 6HCl = 2FeCl₃ + 3H₂O;
(2)稀盐酸显酸性,能使石蕊溶液变红色,如果向变红色的石蕊溶液中加入过量的显碱性的溶液时,溶液由红色变成蓝色;澄清石灰水显碱性,能使酚酞溶液变红色,如果向变红色的酚酞溶液中加入过量的稀盐酸时,溶液由红色变成无色,因此实验后某试管中为红色溶液,可向其中加入足量的稀盐酸,溶液变为无色,由此推断,该试管中最初盛有的物质是无色酚酞溶液;
(3)二氧化碳通入澄清石灰水中时,二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,稀盐酸和碳酸钙反应生成二氧化碳、氯化钙和水,因此过滤后向固体中滴加稀盐酸,一段时间后有气泡出现,该试管中最初发生反应的化学方程式为CO₂ + Ca(OH)₂ = CaCO₃↓ + H₂O;
(4)实验时某试管中始终无明显变化,图中只有氢氧化钙和稀盐酸反应没有现象,化学方程式为Ca(OH)₂ + 2HCl = CaCl₂ + 2H₂O;向其中滴加数滴酚酞溶液,仍无明显现象,说明溶液显中性或盐酸过量,所以一定有氯化钙,可能有盐酸。
查看更多完整答案,请扫码查看


