2025年全优课堂九年级化学下册
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年全优课堂九年级化学下册 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第38页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
5. 完全分解340g溶质质量分数为10%的过氧化氢溶液中的过氧化氢(H₂O₂),最多可生成多少克氧气?
答案:
解:设最多可生成氧气的质量为x。
2H₂O₂$\stackrel{MnO₂}{=\!=\!=}$2H₂O + O₂↑
68 32
340g×10% x
$\frac{68}{32}=\frac{340g×10\%}{x}$
x = 16g
答:最多可生成16g氧气。
2H₂O₂$\stackrel{MnO₂}{=\!=\!=}$2H₂O + O₂↑
68 32
340g×10% x
$\frac{68}{32}=\frac{340g×10\%}{x}$
x = 16g
答:最多可生成16g氧气。
6. 某学习小组在实验室中用加热氯酸钾和二氧化锰混合物的方法制取氧气,反应过程中固体质量的变化如图所示。请计算:
(1) 反应结束后生成氧气的质量为______g。
(2) 冷却至室温,将剩余的固体溶解在85.1g水中,充分溶解后过滤,计算所得不饱和溶液中溶质的质量分数。(计算结果百分号前保留一位小数)
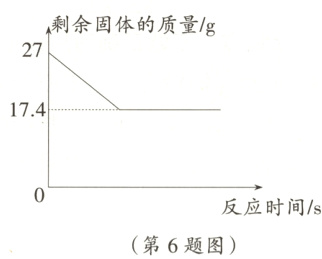
(1) 反应结束后生成氧气的质量为______g。
(2) 冷却至室温,将剩余的固体溶解在85.1g水中,充分溶解后过滤,计算所得不饱和溶液中溶质的质量分数。(计算结果百分号前保留一位小数)

答案:
(1)9.6
(2)解:设生成氯化钾的质量为x。
$2KClO_{3}\xlongequal[\triangle]{MnO_{2}}2KCl + 3O_{2}\uparrow$
149 96
x 9.6g
$\frac{149}{96}=\frac{x}{9.6g}$
x = 14.9g
所得不饱和溶液中溶质的质量分数为$\frac{14.9g}{14.9g + 98.5g}×100\% = 14.9\%$
答:所得不饱和溶液中溶质的质量分数为14.9%。
(1)9.6
(2)解:设生成氯化钾的质量为x。
$2KClO_{3}\xlongequal[\triangle]{MnO_{2}}2KCl + 3O_{2}\uparrow$
149 96
x 9.6g
$\frac{149}{96}=\frac{x}{9.6g}$
x = 14.9g
所得不饱和溶液中溶质的质量分数为$\frac{14.9g}{14.9g + 98.5g}×100\% = 14.9\%$
答:所得不饱和溶液中溶质的质量分数为14.9%。
7. 小莉想探究一只破损手镯(银、锌合金)中银的含量,她称得手镯的质量为22.8g,然后用足量的稀硫酸分多次与此手镯充分反应,实验结果如下表所示,根据下表中的数据分析,回答下列问题。

(1) 手镯中银的质量是______g。
(2) 所用稀硫酸的溶质质量分数是多少?

(1) 手镯中银的质量是______g。
(2) 所用稀硫酸的溶质质量分数是多少?
答案:
(1)18.5
(2)解:分析表格数据可知,每20g稀硫酸完全反应时,消耗的锌的质量为22.8g - 21.5g = 1.3g。
设20g稀硫酸中含有的溶质的质量为x。
H₂SO₄ + Zn = ZnSO₄ + H₂↑
98 65
x 1.3g
$\frac{98}{65}=\frac{x}{1.3g}$
x = 1.96g
所用稀硫酸的溶质质量分数为$\frac{1.96g}{20g}×100\% = 9.8\%$
答:所用稀硫酸的溶质质量分数是9.8%。
(1)18.5
(2)解:分析表格数据可知,每20g稀硫酸完全反应时,消耗的锌的质量为22.8g - 21.5g = 1.3g。
设20g稀硫酸中含有的溶质的质量为x。
H₂SO₄ + Zn = ZnSO₄ + H₂↑
98 65
x 1.3g
$\frac{98}{65}=\frac{x}{1.3g}$
x = 1.96g
所用稀硫酸的溶质质量分数为$\frac{1.96g}{20g}×100\% = 9.8\%$
答:所用稀硫酸的溶质质量分数是9.8%。
8. (辽阳中考) 根据如图所示信息进行计算。(已知 石灰石中的杂质既不溶于水,也不与酸反应)

(1) 15g石灰石中碳酸钙的质量为______g
(2) 计算所得溶液中溶质的质量分数。

(1) 15g石灰石中碳酸钙的质量为______g
(2) 计算所得溶液中溶质的质量分数。
答案:
(1)10
(2)解:设所得溶液中溶质的质量为x。
CaCO₃ + 2HCl = CaCl₂ + H₂O + CO₂↑
100 111
10g x
$\frac{100}{111}=\frac{10g}{x}$
x = 11.1g
所得溶液中溶质的质量分数为$\frac{11.1g}{111g}×100\% = 10\%$
答:所得溶液中溶质的质量分数为10%。
(1)10
(2)解:设所得溶液中溶质的质量为x。
CaCO₃ + 2HCl = CaCl₂ + H₂O + CO₂↑
100 111
10g x
$\frac{100}{111}=\frac{10g}{x}$
x = 11.1g
所得溶液中溶质的质量分数为$\frac{11.1g}{111g}×100\% = 10\%$
答:所得溶液中溶质的质量分数为10%。
查看更多完整答案,请扫码查看


