2025年赢在微点轻松课堂微讲小本高中化学选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年赢在微点轻松课堂微讲小本高中化学选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第81页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
4. 已知下表数据:
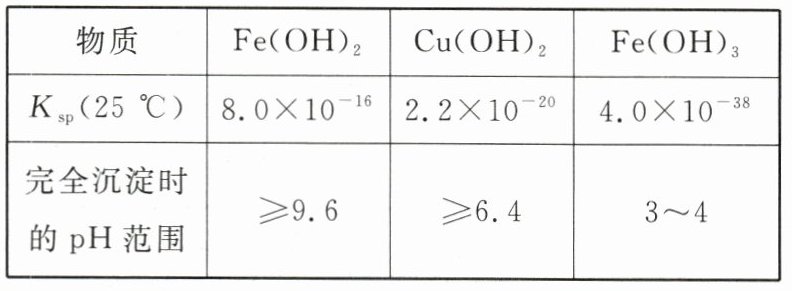
对含等物质的量的\ce{CuSO4}、\ce{FeSO4}、\ce{Fe2(SO4)3}的混合溶液的说法,不正确的是( )
A. 向该混合溶液中逐滴加入\ce{NaOH}溶液,最先看到红褐色沉淀
B. 向该混合溶液中逐滴加入\ce{NaOH}溶液,最先看到白色沉淀
C. 向该混合溶液中加入适量\ce{H2O2},并调节$\text{pH}$到$3~4$后过滤,可获得纯净的\ce{CuSO4}溶液
D. 在$\text{pH}=5$的溶液中\ce{Fe^{3 + }}不能大量存在

对含等物质的量的\ce{CuSO4}、\ce{FeSO4}、\ce{Fe2(SO4)3}的混合溶液的说法,不正确的是( )
A. 向该混合溶液中逐滴加入\ce{NaOH}溶液,最先看到红褐色沉淀
B. 向该混合溶液中逐滴加入\ce{NaOH}溶液,最先看到白色沉淀
C. 向该混合溶液中加入适量\ce{H2O2},并调节$\text{pH}$到$3~4$后过滤,可获得纯净的\ce{CuSO4}溶液
D. 在$\text{pH}=5$的溶液中\ce{Fe^{3 + }}不能大量存在
答案:
B
5. (1)对于$\ce{Ag2S(s)\longrightleftharpoons 2Ag^{+}(aq) + S^{2 - }(aq)}$,其$K_{\text{sp}}$的表达式为________________。
(2)下列说法不正确的是________(填序号)。
①用稀盐酸洗涤$\ce{AgCl}$沉淀比用水洗涤损耗$\ce{AgCl}$少
②一般来说,物质的溶解度随温度的升高而增加,故物质的溶解过程大多是吸热过程
③对于$\ce{Al(OH)3(s)\longrightleftharpoons Al^{3 + }(aq) + 3OH^{-}(aq)}$和$\ce{Al(OH)3\longrightleftharpoons Al^{3 + } + 3OH^{-}}$,前者为溶解平衡,后者为电离平衡
④除去溶液中的$\ce{Mg^{2 + }}$,用$\ce{OH^{-}}$沉淀比用$\ce{CO^{2 - }3}$好,说明$\ce{Mg(OH)2}$的溶解度比$\ce{MgCO3}$大
⑤沉淀反应中常加入过量的沉淀剂,其目的是使沉淀更完全
(3)如何除去$\ce{Mg(OH)2}$中混有的$\ce{Ca(OH)2}$?(已知$K_{\text{sp}}[\ce{Mg(OH)2}]K_{\text{sp}}[\ce{Ca(OH)2}]$)
______________________________。
(2)下列说法不正确的是________(填序号)。
①用稀盐酸洗涤$\ce{AgCl}$沉淀比用水洗涤损耗$\ce{AgCl}$少
②一般来说,物质的溶解度随温度的升高而增加,故物质的溶解过程大多是吸热过程
③对于$\ce{Al(OH)3(s)\longrightleftharpoons Al^{3 + }(aq) + 3OH^{-}(aq)}$和$\ce{Al(OH)3\longrightleftharpoons Al^{3 + } + 3OH^{-}}$,前者为溶解平衡,后者为电离平衡
④除去溶液中的$\ce{Mg^{2 + }}$,用$\ce{OH^{-}}$沉淀比用$\ce{CO^{2 - }3}$好,说明$\ce{Mg(OH)2}$的溶解度比$\ce{MgCO3}$大
⑤沉淀反应中常加入过量的沉淀剂,其目的是使沉淀更完全
(3)如何除去$\ce{Mg(OH)2}$中混有的$\ce{Ca(OH)2}$?(已知$K_{\text{sp}}[\ce{Mg(OH)2}]K_{\text{sp}}[\ce{Ca(OH)2}]$)
______________________________。
答案:
$K_{\text{sp}} = c^{2}(\ce{Ag^{+}})\cdot c(\ce{S^{2 - }})$@@④@@加足量$\ce{MgCl2}$溶液,充分搅拌,过滤,洗涤,干燥即得纯$\ce{Mg(OH)2}$
知识点一 沉淀的生成
1. 调节 pH 法。
加入氨水调节 pH 至 7~8,可除去氯化铵中的杂质氯化铁。反应离子方程式为 _______________。
2. 加沉淀剂法。
以 Na₂S、H₂S 等作沉淀剂,使 Cu²⁺、Hg²⁺等生成极难溶的硫化物 CuS、HgS 等沉淀。反应的离子方程式为_________ 、_________ 、___________ 、___________ 。
1. 调节 pH 法。
加入氨水调节 pH 至 7~8,可除去氯化铵中的杂质氯化铁。反应离子方程式为 _______________。
2. 加沉淀剂法。
以 Na₂S、H₂S 等作沉淀剂,使 Cu²⁺、Hg²⁺等生成极难溶的硫化物 CuS、HgS 等沉淀。反应的离子方程式为_________ 、_________ 、___________ 、___________ 。
答案:
@@$\mathrm{Fe}^{3 + }+3\mathrm{NH}_{3}\cdot\mathrm{H}_{2}\mathrm{O}\xlongequal{}\mathrm{Fe}(\mathrm{OH})_{3}\downarrow + 3\mathrm{NH}_{4}^{+}$
@@$\mathrm{Cu}^{2 + }+\mathrm{S}^{2 - }\xlongequal{}\mathrm{CuS}\downarrow$
@@$\mathrm{Cu}^{2 + }+\mathrm{H}_{2}\mathrm{S}\xlongequal{}\mathrm{CuS}\downarrow + 2\mathrm{H}^{+}$
@@$\mathrm{Hg}^{2 + }+\mathrm{S}^{2 - }\xlongequal{}\mathrm{HgS}\downarrow$
@@$\mathrm{Hg}^{2 + }+\mathrm{H}_{2}\mathrm{S}\xlongequal{}\mathrm{HgS}\downarrow + 2\mathrm{H}^{+}$
@@$\mathrm{Cu}^{2 + }+\mathrm{S}^{2 - }\xlongequal{}\mathrm{CuS}\downarrow$
@@$\mathrm{Cu}^{2 + }+\mathrm{H}_{2}\mathrm{S}\xlongequal{}\mathrm{CuS}\downarrow + 2\mathrm{H}^{+}$
@@$\mathrm{Hg}^{2 + }+\mathrm{S}^{2 - }\xlongequal{}\mathrm{HgS}\downarrow$
@@$\mathrm{Hg}^{2 + }+\mathrm{H}_{2}\mathrm{S}\xlongequal{}\mathrm{HgS}\downarrow + 2\mathrm{H}^{+}$
知识点二 沉淀的溶解
1. 沉淀溶解的原理。
根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去平衡体系中的_________ ,使平衡向 _____________的方向移动,就可以使沉淀溶解。
2. 沉淀溶解的方法。
(1)酸溶解法:用强酸溶解的难溶电解质有 CaCO₃、BaCO₃、FeS、Al(OH)₃、Ca(OH)₂等。
如 CaCO₃难溶于水,却易溶于盐酸,原因是 CaCO₃在水中存在沉淀溶解平衡为 CaCO₃(s)⇌Ca²⁺(aq)+CO₃²⁻(aq),当加入盐酸后发生反应:CO₃²⁻+2H⁺ = H₂O+CO₂↑,c(CO₃²⁻) ________,溶解平衡向______ 方向移动。
(2)盐溶液溶解法:Mg(OH)₂难溶于水,能溶于盐酸、NH₄Cl 溶液中。
溶于 NH₄Cl 溶液反应的离子方程式为 Mg(OH)₂+2NH₄⁺ = Mg²⁺+2NH₃·H₂O。
1. 沉淀溶解的原理。
根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去平衡体系中的_________ ,使平衡向 _____________的方向移动,就可以使沉淀溶解。
2. 沉淀溶解的方法。
(1)酸溶解法:用强酸溶解的难溶电解质有 CaCO₃、BaCO₃、FeS、Al(OH)₃、Ca(OH)₂等。
如 CaCO₃难溶于水,却易溶于盐酸,原因是 CaCO₃在水中存在沉淀溶解平衡为 CaCO₃(s)⇌Ca²⁺(aq)+CO₃²⁻(aq),当加入盐酸后发生反应:CO₃²⁻+2H⁺ = H₂O+CO₂↑,c(CO₃²⁻) ________,溶解平衡向______ 方向移动。
(2)盐溶液溶解法:Mg(OH)₂难溶于水,能溶于盐酸、NH₄Cl 溶液中。
溶于 NH₄Cl 溶液反应的离子方程式为 Mg(OH)₂+2NH₄⁺ = Mg²⁺+2NH₃·H₂O。
答案:
相应离子
@@沉淀溶解
@@减小
@@溶解
@@沉淀溶解
@@减小
@@溶解
查看更多完整答案,请扫码查看


