2025年赢在微点轻松课堂微讲小本高中化学选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年赢在微点轻松课堂微讲小本高中化学选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第11页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
1. 下列有关化学反应与能量变化的说法正确的是 ( )
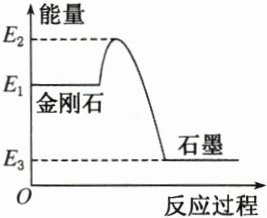
A. 甲烷的燃烧热为 890. 3 kJ·mol⁻¹,则 1 mol 甲烷燃烧时放出的热量一定为 890. 3 kJ
B. 氢气和氧气反应生成液态水时比生成等量的气态水时所放出的热量少
C. 由图可知,金刚石的燃烧热比石墨的燃烧热大
D. 铁在纯氧中完全燃烧时放出的热量就是其燃烧热

A. 甲烷的燃烧热为 890. 3 kJ·mol⁻¹,则 1 mol 甲烷燃烧时放出的热量一定为 890. 3 kJ
B. 氢气和氧气反应生成液态水时比生成等量的气态水时所放出的热量少
C. 由图可知,金刚石的燃烧热比石墨的燃烧热大
D. 铁在纯氧中完全燃烧时放出的热量就是其燃烧热
答案:
C@@解析:1 mol CH₄只有完全燃烧且生成的 CO₂为气态,水为液态时放出的热量才为 890.3 kJ,A 项错误;液态水具有的能量比等量的气态水具有的能量低,故生成液态水时放出的热量多,B 项错误;由题图可知,金刚石的能量比石墨的能量高,C 项正确;没有明确参与反应的铁的物质的量,故 D 项错误。
2. 已知在 25 ℃、101 kPa 下,1 g C₈H₁₈(辛烷)燃烧生成二氧化碳和液态水时放出 48. 40 kJ 的热量。表示上述反应的热化学方程式书写正确的是 ( )
A. C₈H₁₈(l)+$\frac{25}{2}$O₂(g)=8CO₂(g)+9H₂O(g) $\Delta H=-48.40$ kJ·mol⁻¹
B. C₈H₁₈(l)+$\frac{25}{2}$O₂(g)=8CO₂(g)+9H₂O(l) $\Delta H=-5 517.6$ kJ·mol⁻¹
C. C₈H₁₈(l)+$\frac{25}{2}$O₂(g)=8CO₂(g)+9H₂O(l) $\Delta H=+5 517.6$ kJ·mol⁻¹
D. C₈H₁₈(l)+$\frac{25}{2}$O₂(g)=8CO₂(g)+9H₂O(l) $\Delta H=-48.40$ kJ·mol⁻¹
A. C₈H₁₈(l)+$\frac{25}{2}$O₂(g)=8CO₂(g)+9H₂O(g) $\Delta H=-48.40$ kJ·mol⁻¹
B. C₈H₁₈(l)+$\frac{25}{2}$O₂(g)=8CO₂(g)+9H₂O(l) $\Delta H=-5 517.6$ kJ·mol⁻¹
C. C₈H₁₈(l)+$\frac{25}{2}$O₂(g)=8CO₂(g)+9H₂O(l) $\Delta H=+5 517.6$ kJ·mol⁻¹
D. C₈H₁₈(l)+$\frac{25}{2}$O₂(g)=8CO₂(g)+9H₂O(l) $\Delta H=-48.40$ kJ·mol⁻¹
答案:
B@@解析:在 25 ℃、101 kPa 下,1 mol C₈H₁₈燃烧生成 CO₂和液态水时放出的热量为$\frac{48.40\ kJ}{1\ g}×114\ g = 5517.6\ kJ$。解答该题关键要看三点:
一看各物质的状态→A 项中 H₂O 的状态标错。
二看 ΔH 正、负号→反应放热,ΔH<0,C 项错误。
三看热量数值与化学计量数是否对应→A、D 两项中显然不对应,错误。
3. 下列说法中正确的是 ( )
A. 物质燃烧放出的热量是燃烧热
B. 1 mol C 燃烧生成 CO 时放出的热量就是 C 的燃烧热
C. 1 mol H₂燃烧生成水时放出的热量是 H₂的燃烧热
D. 相同条件下,1 mol H₂O(l)完全分解吸收的热量与 H₂、O₂化合生成 1 mol H₂O(l)放出的热量值相等
A. 物质燃烧放出的热量是燃烧热
B. 1 mol C 燃烧生成 CO 时放出的热量就是 C 的燃烧热
C. 1 mol H₂燃烧生成水时放出的热量是 H₂的燃烧热
D. 相同条件下,1 mol H₂O(l)完全分解吸收的热量与 H₂、O₂化合生成 1 mol H₂O(l)放出的热量值相等
答案:
D@@解析:燃烧热是指在 25 ℃、101 kPa 下,1 mol 纯物质完全燃烧生成指定产物时放出的热量,A 项错误;碳燃烧生成的稳定化合物应为 CO₂,B 项错误;H₂燃烧时的条件及生成水的状态不确定,1 mol H₂燃烧生成水放出的热量不一定是 H₂的燃烧热,C 项错误;根据能量守恒定律可知 D 项正确。
4. 根据要求,写出下列反应的热化学方程式:
(1) 1 mol C₂H₄(g)与适量 O₂(g)反应,生成 CO₂(g)和 H₂O(l),放出 1 411 kJ 的热量。
______________________________
(2) 1 mol Al(s)与适量 O₂(g)发生反应,生成 Al₂O₃(s),放出 834. 9 kJ 的热量。
______________________________
(3) 23 g 某液态有机物和一定量的氧气混合点燃,恰好完全反应,生成 27 g 液态水和 22. 4 L CO₂(标准状况)并放出 683. 5 kJ 的热量。
______________________________
(1) 1 mol C₂H₄(g)与适量 O₂(g)反应,生成 CO₂(g)和 H₂O(l),放出 1 411 kJ 的热量。
______________________________
(2) 1 mol Al(s)与适量 O₂(g)发生反应,生成 Al₂O₃(s),放出 834. 9 kJ 的热量。
______________________________
(3) 23 g 某液态有机物和一定量的氧气混合点燃,恰好完全反应,生成 27 g 液态水和 22. 4 L CO₂(标准状况)并放出 683. 5 kJ 的热量。
______________________________
答案:
$C_{2}H_{4}(g)+3O_{2}(g)=2CO_{2}(g)+2H_{2}O(l)$ $\Delta H = - 1411\ kJ·mol^{-1}$@@$2Al(s)+\frac{3}{2}O_{2}(g)=Al_{2}O_{3}(s)$ $\Delta H = - 1669.8\ kJ·mol^{-1}$@@$C_{2}H_{6}O(l)+3O_{2}(g)=2CO_{2}(g)+3H_{2}O(l)$ $\Delta H = - 1367\ kJ·mol^{-1}$@@解析:
(3)结合题意,首先确定某液态有机物的化学式为 C₂H₆O,书写出化学方程式后注明每种物质的聚集状态,再计算 ΔH 即可。
(3)结合题意,首先确定某液态有机物的化学式为 C₂H₆O,书写出化学方程式后注明每种物质的聚集状态,再计算 ΔH 即可。
查看更多完整答案,请扫码查看


