2025年赢在微点轻松课堂微讲小本高中化学选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年赢在微点轻松课堂微讲小本高中化学选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第49页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
1. 诺贝尔化学奖曾授予致力于研究合成氨与催化剂表面积大小关系的德国科学家格哈德·埃特尔,表彰他在固体表面化学研究过程中作出的贡献。下列说法中正确的是 ( )
A. 增大催化剂的表面积,能增大氨气的产率
B. 增大催化剂的表面积,能加快合成氨的正反应速率、降低逆反应速率
C. 采用合适的催化剂时,反应的活化能降低,使反应明显加快
D. 工业生产中,合成氨采用的压强越高,温度越低,越有利于提高经济效益
A. 增大催化剂的表面积,能增大氨气的产率
B. 增大催化剂的表面积,能加快合成氨的正反应速率、降低逆反应速率
C. 采用合适的催化剂时,反应的活化能降低,使反应明显加快
D. 工业生产中,合成氨采用的压强越高,温度越低,越有利于提高经济效益
答案:
C@@解析 增大催化剂的表面积只能改变反应速率,不能使平衡移动,所以氨气的产率不变,A项错误;增大催化剂的表面积,能加快合成氨的正反应速率和逆反应速率,B项错误;催化剂的作用是降低反应的活化能,使活化分子的百分数增大,有效碰撞次数增加,反应速率加快,C项正确;温度越低,催化剂的活性越低,反应速率越慢,不利于提高经济效益,D项错误。
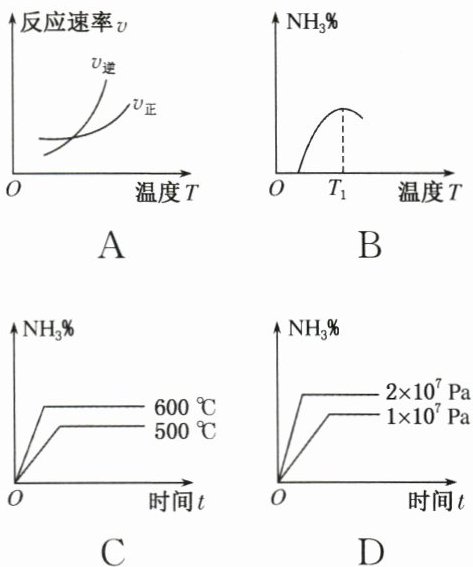
2. 工业合成氨的正反应是放热反应,下列关于反应$\ce{N_{2}(g) + 3H_{2}(g)\rightleftharpoons 2NH_{3}(g)}$的图像中,错误的是 ( )

答案:
C@@解析 合成氨的正反应是放热反应,升温,正、逆反应速率都增大,但逆反应速率增大的程度大,A项正确;在T₁时NH₃%最大,达到平衡,再升高温度,平衡逆向移动,NH₃%缩小,B项正确;低温下达到平衡,NH₃%大,C项错误;增大压强,平衡向右移动,NH₃%增大,D项正确。
3. 合成氨工业中,原料气($\ce{N_{2}}$,$\ce{H_{2}}$及少量的$\ce{CO}$、$\ce{NH_{3}}$的混合气)在进入合成塔前常用乙酸二氨合铜溶液来吸收原料气中的$\ce{CO}$,其反应为$[\ce{Cu(NH_{3})_{2}}]^{+} + \ce{CO} + \ce{NH_{3}} \rightleftharpoons [\ce{Cu(NH_{3})_{3}CO}]^{+} \ \Delta H<0$。下列说法错误的是 ( )
A. 必须除去原料气中的$\ce{CO}$原因是防止催化剂中毒
B. 吸收$\ce{CO}$的生产适宜条件:适当温度、加压,压强越大越好
C. 吸收$\ce{CO}$后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收$\ce{CO}$的能力以供循环使用,再生的适宜条件为高温、低压
D. 合成氨工业中,采用循环操作,主要是为了提高$\ce{N_{2}}$和$\ce{H_{2}}$的利用率
A. 必须除去原料气中的$\ce{CO}$原因是防止催化剂中毒
B. 吸收$\ce{CO}$的生产适宜条件:适当温度、加压,压强越大越好
C. 吸收$\ce{CO}$后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收$\ce{CO}$的能力以供循环使用,再生的适宜条件为高温、低压
D. 合成氨工业中,采用循环操作,主要是为了提高$\ce{N_{2}}$和$\ce{H_{2}}$的利用率
答案:
B@@解析 由于CO参与,易使催化剂中毒,所以必须除去原料气中的CO,A项正确;该反应是气体体积缩小的放热反应,故促进反应向正反应方向进行,应选择低温加压,但不是压强越大越好,B项错误;要使吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,只要使平衡向逆反应方向移动即可,逆反应方向为气体体积增大的吸热反应,所以在高温低压下使平衡逆向移动,C项正确;合成氨工业中,为了提高N₂和H₂的利用率,采用循环操作,D项正确。
4. 合成氨反应达到平衡时,$\ce{NH_{3}}$的体积分数与温度、压强的关系如图所示。根据此图分析合成氨工业最有前途的研究方向是 ( )

A. 提高分离技术
B. 研制耐高压的合成塔
C. 研制低温催化剂
D. 探索不用$\ce{N_{2}}$和$\ce{H_{2}}$合成氨的新途径

A. 提高分离技术
B. 研制耐高压的合成塔
C. 研制低温催化剂
D. 探索不用$\ce{N_{2}}$和$\ce{H_{2}}$合成氨的新途径
答案:
C@@解析 由图可知,φ(NH₃)随着温度的升高而显著下降,故要提高φ(NH₃)必须降低温度,但目前所用催化剂——铁触媒活性最大时的温度在700 K左右,故最有前途的研究方向是研制低温催化剂。
查看更多完整答案,请扫码查看


