2025年赢在微点轻松课堂微讲小本高中化学选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年赢在微点轻松课堂微讲小本高中化学选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第43页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
3. 某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中,$p$表示压强,$T$表示温度,$n$表示物质的量,$t$表示反应时间):
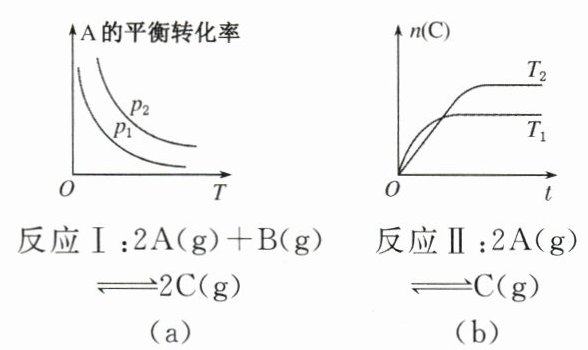

根据以上规律判断(填“>”“=”或“”):
(1)反应Ⅰ:$p_2$______$p_1$,$\Delta H$______0。
(2)反应Ⅱ:$T_1$______$T_2$,$\Delta H$______0。
(3)反应Ⅲ:若$T_2$______$T_1$,$\Delta H$______0。
(4)反应Ⅳ:若$T_2$______$T_1$,$\Delta H$______0。


根据以上规律判断(填“>”“=”或“”):
(1)反应Ⅰ:$p_2$______$p_1$,$\Delta H$______0。
(2)反应Ⅱ:$T_1$______$T_2$,$\Delta H$______0。
(3)反应Ⅲ:若$T_2$______$T_1$,$\Delta H$______0。
(4)反应Ⅳ:若$T_2$______$T_1$,$\Delta H$______0。
答案:
>@@<@@>@@<@@>@@>@@>@@>@@解析
(1)对反应Ⅰ而言,增大压强,平衡向右移动,A的转化率$\alpha(A)$增大,所以$p_2>p_1$;图(a)表示随温度升高,$\alpha(A)$减小,平衡向左移动,则正反应是放热反应,$\Delta H<0$。
(2)图(b)表示在两种不同温度下,C的物质的量逐渐增大至达到平衡的过程。$T_1$温度下$n(C)$增加得快,且先达到平衡,说明$T_1>T_2$,由$T_1\rightarrow T_2$,降低温度,$n(C)$增大,说明平衡向右移动,$\Delta H<0$。
(3)图(c)表示随起始时$n(B)$的增大,在两种不同温度下C的体积分数$\varphi(C)$先增大后减小的变化曲线。$T_2$时$\varphi(C)$高于$T_1$时$\varphi(C)$,可能有两种情况:若$T_2>T_1$,即升温平衡右移,$\Delta H>0$;若$T_2<T_1$,即降温平衡右移,$\Delta H<0$。
(4)图(d)所呈现的信息是随压强的增大,A的平衡转化率不变,但$T_2$时$\alpha(A)$比$T_1$时$\alpha(A)$大。若$T_2>T_1$,则升温平衡右移,$\Delta H>0$;若$T_1>T_2$,则升温平衡左移,$\Delta H<0$。
(1)对反应Ⅰ而言,增大压强,平衡向右移动,A的转化率$\alpha(A)$增大,所以$p_2>p_1$;图(a)表示随温度升高,$\alpha(A)$减小,平衡向左移动,则正反应是放热反应,$\Delta H<0$。
(2)图(b)表示在两种不同温度下,C的物质的量逐渐增大至达到平衡的过程。$T_1$温度下$n(C)$增加得快,且先达到平衡,说明$T_1>T_2$,由$T_1\rightarrow T_2$,降低温度,$n(C)$增大,说明平衡向右移动,$\Delta H<0$。
(3)图(c)表示随起始时$n(B)$的增大,在两种不同温度下C的体积分数$\varphi(C)$先增大后减小的变化曲线。$T_2$时$\varphi(C)$高于$T_1$时$\varphi(C)$,可能有两种情况:若$T_2>T_1$,即升温平衡右移,$\Delta H>0$;若$T_2<T_1$,即降温平衡右移,$\Delta H<0$。
(4)图(d)所呈现的信息是随压强的增大,A的平衡转化率不变,但$T_2$时$\alpha(A)$比$T_1$时$\alpha(A)$大。若$T_2>T_1$,则升温平衡右移,$\Delta H>0$;若$T_1>T_2$,则升温平衡左移,$\Delta H<0$。
知识点一 自发反应
1. 含义:在给定条件下可以自发进行的反应。
2. 特征:具有__________。即反应的某个方向在一定条件下是自发的,而其逆反应在该条件下是非自发的。
知识点二 化学反应进行的方向与焓变的关系
多数自发进行的化学反应是放热反应,但也有很多吸热反应能自发进行,因此,反应焓变是与反应进行的方向有关的因素之一,但不是决定反应能否自发进行的唯一因素。
知识点三 化学反应进行的方向与熵变的关系
1. 熵的概念。
自发过程的体系趋向于由__________转变为__________,体系的混乱度__________。体系的混乱度常用熵来描述,熵的概念是表示体系的__________程度的物理量,其符号为 S。熵值越大,体系的__________越大。
2. 影响熵大小的因素。
(1)同一条件下,不同的物质熵值__________。
(2)同一物质的熵与其聚集状态及外界条件有关,如对同一种物质不同状态时熵值大小为 S(g)____S(l)____S(s)。
(3)气体物质的物质的量越大,分子数越多,熵值越__________。
3. 根据 ΔS 判断反应进行的方向。
(1)当 ΔS>0 时,反应为__________反应,在一定条件下__________自发进行。
(2)当 ΔS0 时,反应为__________反应,在一定条件下__________自发进行。
4. 反应熵变是与反应进行的方向有关的因素之一,但不是决定反应能否自发进行的唯一因素。
知识点四 自由能与化学反应的方向
体系的自由能变化(符号为 ΔG,单位为 kJ·mol⁻¹)综合考虑了焓变和熵变对体系的影响,可用于化学反应自发进行的方向的判断,ΔG = ____________。
$\begin{cases}\Delta G \_\_ 0 & \text{反应能自发进行} \\\Delta G = 0 & \text{反应达到平衡状态} \\\Delta G \_\_ 0 & \text{反应不能自发进行}\end{cases}$
由此可知:
(1)当 ΔH0,ΔS>0 时,反应能自发进行。
(2)当 ΔH>0,ΔS0 时,反应不能自发进行。
(3)当 ΔH>0,ΔS>0 或 ΔH0,ΔS0 时,反应是否能自发进行与温度有关,一般低温时焓变影响为主,高温时熵变影响为主。
【微思考】用 ΔG 判断化学反应的方向是否适用于任何条件下的反应?
1. 含义:在给定条件下可以自发进行的反应。
2. 特征:具有__________。即反应的某个方向在一定条件下是自发的,而其逆反应在该条件下是非自发的。
知识点二 化学反应进行的方向与焓变的关系
多数自发进行的化学反应是放热反应,但也有很多吸热反应能自发进行,因此,反应焓变是与反应进行的方向有关的因素之一,但不是决定反应能否自发进行的唯一因素。
知识点三 化学反应进行的方向与熵变的关系
1. 熵的概念。
自发过程的体系趋向于由__________转变为__________,体系的混乱度__________。体系的混乱度常用熵来描述,熵的概念是表示体系的__________程度的物理量,其符号为 S。熵值越大,体系的__________越大。
2. 影响熵大小的因素。
(1)同一条件下,不同的物质熵值__________。
(2)同一物质的熵与其聚集状态及外界条件有关,如对同一种物质不同状态时熵值大小为 S(g)____S(l)____S(s)。
(3)气体物质的物质的量越大,分子数越多,熵值越__________。
3. 根据 ΔS 判断反应进行的方向。
(1)当 ΔS>0 时,反应为__________反应,在一定条件下__________自发进行。
(2)当 ΔS0 时,反应为__________反应,在一定条件下__________自发进行。
4. 反应熵变是与反应进行的方向有关的因素之一,但不是决定反应能否自发进行的唯一因素。
知识点四 自由能与化学反应的方向
体系的自由能变化(符号为 ΔG,单位为 kJ·mol⁻¹)综合考虑了焓变和熵变对体系的影响,可用于化学反应自发进行的方向的判断,ΔG = ____________。
$\begin{cases}\Delta G \_\_ 0 & \text{反应能自发进行} \\\Delta G = 0 & \text{反应达到平衡状态} \\\Delta G \_\_ 0 & \text{反应不能自发进行}\end{cases}$
由此可知:
(1)当 ΔH0,ΔS>0 时,反应能自发进行。
(2)当 ΔH>0,ΔS0 时,反应不能自发进行。
(3)当 ΔH>0,ΔS>0 或 ΔH0,ΔS0 时,反应是否能自发进行与温度有关,一般低温时焓变影响为主,高温时熵变影响为主。
【微思考】用 ΔG 判断化学反应的方向是否适用于任何条件下的反应?
答案:
方向性@@有序@@无序@@增大@@混乱@@混乱度@@不同@@>@@>@@大@@熵增@@能@@熵减@@不能@@ΔH - TΔS@@<@@>@@提示 根据ΔG = ΔH - TΔS判断化学反应的方向只能用于温度和压强一定的条件下的反应,不能用于其他条件下(如温度、体积一定)的反应。
查看更多完整答案,请扫码查看


