2025年赢在微点轻松课堂微讲小本高中化学选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年赢在微点轻松课堂微讲小本高中化学选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第62页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
1. 常温下,将$0.1\ mol\cdot L^{-1}\ HCl$溶液和$0.06\ mol\cdot L^{-1}$的$Ba(OH)_2$溶液等体积混合后,则该溶液的$pH$是 ( )
A. 1.7
B. 12.3
C. 12
D. 1
A. 1.7
B. 12.3
C. 12
D. 1
答案:
C@@解析:这是强酸和强碱的混合,要先判断混合液的酸碱性。酸中$c(H^{+}) = 0.1\ mol\cdot L^{-1}$,碱中$c(OH^{-}) = 0.12\ mol\cdot L^{-1}$,等体积混合碱过量,根据pH的计算方法,要先求$c(OH^{-})$,再求$c(H^{+})$,最后求pH。$c(OH^{-})_{余}=\frac{c(OH^{-})\cdot V_{碱}-c(H^{+})\cdot V_{酸}}{V_{酸}+V_{碱}} = 0.01\ mol\cdot L^{-1}$,$c(H^{+})=\frac{K_{w}}{c(OH^{-})_{余}} = 1\times10^{-12}\ mol\cdot L^{-1}$,$pH = -\lg c(H^{+}) = 12$。故选C。
2. 常温下,若 1 体积硫酸与 2 体积$pH = 11$的氢氧化钠溶液混合后的溶液的$pH = 3$(混合后体积变化不计),则二者物质的量浓度之比应 ( )
A. $5:1$
B. $5:2$
C. $1:5$
D. $2:5$
A. $5:1$
B. $5:2$
C. $1:5$
D. $2:5$
答案:
B@@解析:$H_{2}SO_{4}+2NaOH = Na_{2}SO_{4}+2H_{2}O$,设硫酸的物质的量浓度为$c\ mol\cdot L^{-1}$,体积为$V\ L$,氢氧化钠溶液浓度为$10^{-3}\ mol\cdot L^{-1}$,体积为$2V\ L$,混合后$pH = 3$,即$c(H^{+})=\frac{2c\cdot V - 10^{-3}\times2V}{3V}\ mol\cdot L^{-1}=10^{-3}\ mol\cdot L^{-1}$,解得$c = \frac{5}{2}\times10^{-3}$,则二者物质的量浓度之比应为$5:2$,B项正确。
3. 在$25\ ^{\circ}C$的条件下,将体积都为$10\ mL$,$pH$都等于 3 的醋酸和盐酸,加水稀释到$a\ mL$和$b\ mL$,测得稀释后溶液的$pH$均为 5,则稀释时加入水的体积为 ( )
A. $a = b = 1000\ mL$
B. $a = b>1000\ mL$
C. $a b$
D. $a > b$
A. $a = b = 1000\ mL$
B. $a = b>1000\ mL$
C. $a b$
D. $a > b$
答案:
D@@解析:若$a = b$,稀释后的$CH_{3}COOH$溶液$pH < 5$,若使$CH_{3}COOH$溶液$pH = 5$,就必须继续加水稀释,即$a > b$。
4. 室温时,将$x\ mL\ pH = a$的稀$NaOH$溶液与$y\ mL\ pH = b$的稀盐酸充分反应。下列关于反应后溶液$pH$的判断,正确的是 ( )
A. 若$x = y$,且$a + b = 14$,则$pH>7$
B. 若$10x = y$,且$a + b = 13$,则$pH = 7$
C. 若$ax = by$,且$a + b = 13$,则$pH = 7$
D. 若$x = 10y$,且$a + b = 14$,则$pH>7$
A. 若$x = y$,且$a + b = 14$,则$pH>7$
B. 若$10x = y$,且$a + b = 13$,则$pH = 7$
C. 若$ax = by$,且$a + b = 13$,则$pH = 7$
D. 若$x = 10y$,且$a + b = 14$,则$pH>7$
答案:
D@@解析:$y\ mL\ pH = b$的盐酸中,$n(H^{+}) = y\cdot10^{-b}\times10^{-3}\ mol$;$x\ mL\ pH = a$的$NaOH$溶液中,$n(OH^{-}) = x\cdot10^{-(14 - a)}\times10^{-3}\ mol$。紧扣$\frac{n(H^{+})}{n(OH^{-})}$来列式分析:$\frac{n(H^{+})}{n(OH^{-})}=\frac{y\cdot10^{-b}\times10^{-3}}{x\cdot10^{-(14 - a)}\times10^{-3}}=\frac{y}{x}\cdot10^{14-(a + b)}$。若$x = y$,且$a + b = 14$,则$\frac{n(H^{+})}{n(OH^{-})}=1$,$pH = 7$,A项错误;若$10x = y$,且$a + b = 13$,则$\frac{n(H^{+})}{n(OH^{-})}=100$,$pH < 7$,B项错误;若$ax = by$,且$a + b = 13$,则$\frac{n(H^{+})}{n(OH^{-})}=\frac{10a}{b}>10$(因为$a > 7$,$b < 7$),$pH < 7$,C项错误;若$x = 10y$,且$a + b = 14$,则$\frac{n(H^{+})}{n(OH^{-})}=\frac{1}{10}<1$,$pH > 7$,D项正确。
5.(1)某温度($T\ ^{\circ}C$)时,测得$0.01\ mol\cdot L^{-1}\ NaOH$溶液的$pH = 11$,则该温度下水的$K_w =$________。
(2)在此温度下,将$pH = a$的$NaOH$溶液$V_a\ L$与$pH = b$的$H_2SO_4$溶液$V_b\ L$混合。
①若所得混合液为中性,且$a = 11$,$b = 3$,则$V_a:V_b =$________。
②若所得混合液为中性,且$V_a:V_b = 10:1$,则$a + b =$__________。
③若所得混合液的$pH = 10$,且$a = 12$,$b = 2$,则$V_a:V_b =$________。
(2)在此温度下,将$pH = a$的$NaOH$溶液$V_a\ L$与$pH = b$的$H_2SO_4$溶液$V_b\ L$混合。
①若所得混合液为中性,且$a = 11$,$b = 3$,则$V_a:V_b =$________。
②若所得混合液为中性,且$V_a:V_b = 10:1$,则$a + b =$__________。
③若所得混合液的$pH = 10$,且$a = 12$,$b = 2$,则$V_a:V_b =$________。
答案:
$10^{-13}$@@$1:10$@@$12$@@$1:9$@@解析:
(1)$T\ ^{\circ}C$时,$0.01\ mol\cdot L^{-1}$的$NaOH$溶液中$c(OH^{-}) = 1\times10^{-2}\ mol\cdot L^{-1}$,其$pH = 11$,即$c(H^{+}) = 1\times10^{-11}\ mol\cdot L^{-1}$,则水的离子积为$10^{-13}$。
(2)①$pH = 11$的$NaOH$溶液中$c(OH^{-}) = 1\times10^{-2}\ mol\cdot L^{-1}$,$pH = 3$的$H_{2}SO_{4}$溶液中$c(H^{+}) = 1\times10^{-3}\ mol\cdot L^{-1}$,若混合后呈中性,则硫酸溶液的体积为氢氧化钠溶液体积的10倍,即$V_{a}:V_{b}=1:10$。②酸中$n(H^{+}) = V_{b}\ L\times10^{-b}\ mol\cdot L^{-1}$,碱中$c(OH^{-})=\frac{10^{-13}}{10^{-a}}\ mol\cdot L^{-1}=10^{-13 + a}\ mol\cdot L^{-1}$,若混合后呈中性,则$V_{b}\times10^{-b}=V_{a}\times10^{-13 + a}$,即$\frac{V_{a}}{V_{b}} = 10^{13 - a - b}=10$,即$a + b = 12$。③若混合后$pH = 10$,即$c(OH^{-})=\frac{10^{-13}}{10^{-10}}\ mol\cdot L^{-1}=1\times10^{-3}\ mol\cdot L^{-1}$,故$\frac{0.1V_{a}-0.01V_{b}}{V_{a}+V_{b}} = 1\times10^{-3}$,即$V_{a}:V_{b}=1:9$。
(1)$T\ ^{\circ}C$时,$0.01\ mol\cdot L^{-1}$的$NaOH$溶液中$c(OH^{-}) = 1\times10^{-2}\ mol\cdot L^{-1}$,其$pH = 11$,即$c(H^{+}) = 1\times10^{-11}\ mol\cdot L^{-1}$,则水的离子积为$10^{-13}$。
(2)①$pH = 11$的$NaOH$溶液中$c(OH^{-}) = 1\times10^{-2}\ mol\cdot L^{-1}$,$pH = 3$的$H_{2}SO_{4}$溶液中$c(H^{+}) = 1\times10^{-3}\ mol\cdot L^{-1}$,若混合后呈中性,则硫酸溶液的体积为氢氧化钠溶液体积的10倍,即$V_{a}:V_{b}=1:10$。②酸中$n(H^{+}) = V_{b}\ L\times10^{-b}\ mol\cdot L^{-1}$,碱中$c(OH^{-})=\frac{10^{-13}}{10^{-a}}\ mol\cdot L^{-1}=10^{-13 + a}\ mol\cdot L^{-1}$,若混合后呈中性,则$V_{b}\times10^{-b}=V_{a}\times10^{-13 + a}$,即$\frac{V_{a}}{V_{b}} = 10^{13 - a - b}=10$,即$a + b = 12$。③若混合后$pH = 10$,即$c(OH^{-})=\frac{10^{-13}}{10^{-10}}\ mol\cdot L^{-1}=1\times10^{-3}\ mol\cdot L^{-1}$,故$\frac{0.1V_{a}-0.01V_{b}}{V_{a}+V_{b}} = 1\times10^{-3}$,即$V_{a}:V_{b}=1:9$。
知识点一 酸碱中和滴定
1.概念。
依据中和反应,用________的酸(或碱)来测定________的碱(或酸)的方法。
2.原理。
(1)实质:________________(填离子方程式)。
(2)原理:酸提供的 H⁺与碱提供的 OH⁻的________相等。
即$c(\mathrm{H}^{+})\cdot V_{\mathrm{酸}} = c(\mathrm{OH}^{-})\cdot V_{\mathrm{碱}}$(均为强电解质)。
3.仪器和试剂。
(1)仪器$\begin{cases}\_\_\_\_\_\_\_\_(如图 a)\\ \_\_\_\_\_\_\_\_(如图 b)\\ 滴定管夹、\_\_\_\_\_、\_\_\_\_\_、\_\_\_\_\_\end{cases}$
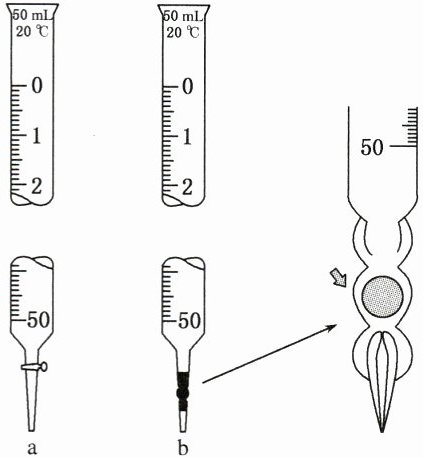
(2)试剂:标准液、待测液、指示剂。
4.实验操作(以用盐酸标准液滴定 NaOH 溶液为例)。
(1)滴定管的使用方法。
①检查仪器:使用滴定管前,首先要检查________。
②润洗仪器:滴定管加入酸、碱反应液之前,洁净的酸式滴定管和碱式滴定管要分别用________润洗________次。
③加入反应液:分别将酸、碱反应液加入酸式滴定管、碱式滴定管中,使液面位于“0”刻度以上________处,并将滴定管垂直固定在滴定管夹上。
④调节起始读数:调节活塞或玻璃球,使滴定管尖嘴部分充满反应液,并使液面处于________,准确读取读数并记录。
⑤放出反应液:从碱式滴定管中放出一定量的 NaOH 溶液于锥形瓶中,并滴 2~3 滴指示剂(甲基橙或酚酞)。
(2)滴定。
①左手握________,右手摇动________。
②眼睛注视________。
③终点判断:当滴入最后半滴盐酸时,刚好使锥形瓶中的溶液变色,且在半分钟内不恢复原色,即到终点。读数并记录。
5.实验数据的处理。
重复滴定操作 2~3 次,取消耗标准液体积的平均值,根据$c(\mathrm{NaOH})=\frac{c(\mathrm{HCl})\cdot V[\mathrm{HCl}(\mathrm{aq})]}{V[\mathrm{NaOH}(\mathrm{aq})]}$,计算出待测 NaOH 溶液的浓度$c(\mathrm{NaOH})$。
【微思考】(1)若量程为 50 mL 的滴定管,从中放出 25 mL 液体,滴定管中还剩 25 mL 液体吗?
(2)酸式滴定管必须盛酸溶液,碱式滴定管必须盛碱溶液,两者能交换盛装吗?
1.概念。
依据中和反应,用________的酸(或碱)来测定________的碱(或酸)的方法。
2.原理。
(1)实质:________________(填离子方程式)。
(2)原理:酸提供的 H⁺与碱提供的 OH⁻的________相等。
即$c(\mathrm{H}^{+})\cdot V_{\mathrm{酸}} = c(\mathrm{OH}^{-})\cdot V_{\mathrm{碱}}$(均为强电解质)。
3.仪器和试剂。
(1)仪器$\begin{cases}\_\_\_\_\_\_\_\_(如图 a)\\ \_\_\_\_\_\_\_\_(如图 b)\\ 滴定管夹、\_\_\_\_\_、\_\_\_\_\_、\_\_\_\_\_\end{cases}$

(2)试剂:标准液、待测液、指示剂。
4.实验操作(以用盐酸标准液滴定 NaOH 溶液为例)。
(1)滴定管的使用方法。
①检查仪器:使用滴定管前,首先要检查________。
②润洗仪器:滴定管加入酸、碱反应液之前,洁净的酸式滴定管和碱式滴定管要分别用________润洗________次。
③加入反应液:分别将酸、碱反应液加入酸式滴定管、碱式滴定管中,使液面位于“0”刻度以上________处,并将滴定管垂直固定在滴定管夹上。
④调节起始读数:调节活塞或玻璃球,使滴定管尖嘴部分充满反应液,并使液面处于________,准确读取读数并记录。
⑤放出反应液:从碱式滴定管中放出一定量的 NaOH 溶液于锥形瓶中,并滴 2~3 滴指示剂(甲基橙或酚酞)。
(2)滴定。
①左手握________,右手摇动________。
②眼睛注视________。
③终点判断:当滴入最后半滴盐酸时,刚好使锥形瓶中的溶液变色,且在半分钟内不恢复原色,即到终点。读数并记录。
5.实验数据的处理。
重复滴定操作 2~3 次,取消耗标准液体积的平均值,根据$c(\mathrm{NaOH})=\frac{c(\mathrm{HCl})\cdot V[\mathrm{HCl}(\mathrm{aq})]}{V[\mathrm{NaOH}(\mathrm{aq})]}$,计算出待测 NaOH 溶液的浓度$c(\mathrm{NaOH})$。
【微思考】(1)若量程为 50 mL 的滴定管,从中放出 25 mL 液体,滴定管中还剩 25 mL 液体吗?
(2)酸式滴定管必须盛酸溶液,碱式滴定管必须盛碱溶液,两者能交换盛装吗?
答案:
已知浓度
@@未知浓度
@@$H^{+}+OH^{-}\xlongequal{\;\;}H_{2}O$
@@物质的量
@@酸式滴定管
@@碱式滴定管
@@铁架台
@@烧杯
@@锥形瓶
@@是否漏水
@@所要盛装的酸溶液或碱溶液
@@2~3
@@2~3 mL
@@“0”刻度或“0”刻度以下的某刻度
@@滴定管活塞
@@锥形瓶
@@锥形瓶内溶液颜色的变化
@@提示
(1)所剩液体大于 25 mL。
@@
(2)不能换装,因为酸式滴定管有磨砂的玻璃活塞,容易被碱液腐蚀;碱式滴定管有橡胶管,容易被酸性溶液腐蚀。
@@未知浓度
@@$H^{+}+OH^{-}\xlongequal{\;\;}H_{2}O$
@@物质的量
@@酸式滴定管
@@碱式滴定管
@@铁架台
@@烧杯
@@锥形瓶
@@是否漏水
@@所要盛装的酸溶液或碱溶液
@@2~3
@@2~3 mL
@@“0”刻度或“0”刻度以下的某刻度
@@滴定管活塞
@@锥形瓶
@@锥形瓶内溶液颜色的变化
@@提示
(1)所剩液体大于 25 mL。
@@
(2)不能换装,因为酸式滴定管有磨砂的玻璃活塞,容易被碱液腐蚀;碱式滴定管有橡胶管,容易被酸性溶液腐蚀。
查看更多完整答案,请扫码查看


