2025年赢在微点轻松课堂微讲小本高中化学选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年赢在微点轻松课堂微讲小本高中化学选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第22页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
1. 增加固体反应物的质量,化学反应速率增大。 ( )
2. 任何反应,增大压强,反应速率一定增大。 ( )
3. 恒温恒容密闭容器中发生全为气体的反应,若容器总压强增大,则反应速率一定增大。 ( )
4. 升高温度,吸热反应速率会加快而放热反应速率会减慢。 ( )
2. 任何反应,增大压强,反应速率一定增大。 ( )
3. 恒温恒容密闭容器中发生全为气体的反应,若容器总压强增大,则反应速率一定增大。 ( )
4. 升高温度,吸热反应速率会加快而放热反应速率会减慢。 ( )
答案:
×
@@×
@@×
@@×
@@×
@@×
@@×
1. 活化能。
(1)基元反应。
大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。例如,$2HI\xlongequal{\;\;}H_{2}+I_{2}$实际上经过下列两步反应完成:
$2HI\longrightarrow H_{2}+2I\cdot$
$2I\cdot\longrightarrow I_{2}$
每一步反应都称为____。
(2)有效碰撞。

(3)活化分子和活化能。
①活化分子:能够发生____的分子必须具有足够的能量。
②活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差。
(4)反应物、生成物的能量与活化能的关系图。
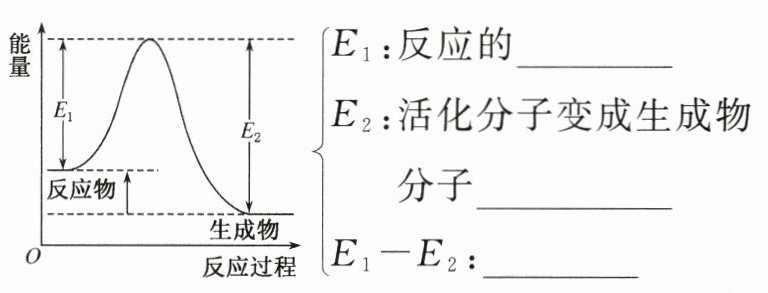
2. 用碰撞理论解释化学反应速率的影响因素。
(1)浓度:反应物浓度增大→单位体积内活化分子数____→单位时间内有效碰撞的次数____→反应速率____;反之,反应速率____。
(2)压强(有气体参加的反应):增大压强→气体体积缩小→反应物浓度增大→单位体积内活化分子数____→单位时间内有效碰撞的次数____→反应速率____;反之,反应速率____。
(3)温度:升高温度→活化分子的百分数____,单位体积内活化分子数____→单位时间内有效碰撞的次数____→反应速率____;反之,反应速率____。
(4)催化剂:使用催化剂→改变____(如图),反应的活化能____→活化分子的百分数____,单位体积内活化分子数____→单位时间内有效碰撞的次数____→反应速率____。

(1)基元反应。
大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。例如,$2HI\xlongequal{\;\;}H_{2}+I_{2}$实际上经过下列两步反应完成:
$2HI\longrightarrow H_{2}+2I\cdot$
$2I\cdot\longrightarrow I_{2}$
每一步反应都称为____。
(2)有效碰撞。

(3)活化分子和活化能。
①活化分子:能够发生____的分子必须具有足够的能量。
②活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差。
(4)反应物、生成物的能量与活化能的关系图。

2. 用碰撞理论解释化学反应速率的影响因素。
(1)浓度:反应物浓度增大→单位体积内活化分子数____→单位时间内有效碰撞的次数____→反应速率____;反之,反应速率____。
(2)压强(有气体参加的反应):增大压强→气体体积缩小→反应物浓度增大→单位体积内活化分子数____→单位时间内有效碰撞的次数____→反应速率____;反之,反应速率____。
(3)温度:升高温度→活化分子的百分数____,单位体积内活化分子数____→单位时间内有效碰撞的次数____→反应速率____;反之,反应速率____。
(4)催化剂:使用催化剂→改变____(如图),反应的活化能____→活化分子的百分数____,单位体积内活化分子数____→单位时间内有效碰撞的次数____→反应速率____。

答案:
基元反应@@越快@@有效碰撞@@活化能@@放出的能量@@反应热@@增多@@增加@@增大@@减小@@增多@@增加@@增大@@减小@@增加@@增加@@增加@@增大@@减小@@反应历程@@降低@@增大@@增加@@增加@@增大
微判断
1. 活化能大的反应一定是吸热反应。 ( )
2. 有效碰撞次数多,反应速率快。 ( )
3. 催化剂能降低反应所需的活化能,$\Delta H$也会发生变化。 ( )
4. 只要条件合适,普通分子之间的碰撞也可能是有效碰撞。 ( )
1. 活化能大的反应一定是吸热反应。 ( )
2. 有效碰撞次数多,反应速率快。 ( )
3. 催化剂能降低反应所需的活化能,$\Delta H$也会发生变化。 ( )
4. 只要条件合适,普通分子之间的碰撞也可能是有效碰撞。 ( )
答案:
×
@@×
@@×
@@×
@@×
@@×
@@×
查看更多完整答案,请扫码查看


