2025年赢在微点轻松课堂微讲小本高中化学选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年赢在微点轻松课堂微讲小本高中化学选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第53页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
知识点二 弱电解质的电离平衡
1. 弱电解质的电离平衡的建立。
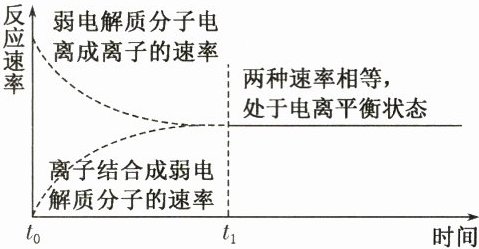
在一定条件下(如温度和浓度),____________________的速率和____________________的速率相等时,电离过程达到电离平衡状态。
1. 弱电解质的电离平衡的建立。

在一定条件下(如温度和浓度),____________________的速率和____________________的速率相等时,电离过程达到电离平衡状态。
答案:
弱电解质分子电离成离子
@@离子结合成分子
@@离子结合成分子
2. 弱电解质电离平衡的特征。


答案:
可逆@@相等@@动态@@恒定@@移动
3. 外界条件对电离平衡的影响。
以 0.1 mol·L⁻¹ CH₃COOH 溶液为例:CH₃COOH⇌CH₃COO⁻ + H⁺(正向吸热)。

以 0.1 mol·L⁻¹ CH₃COOH 溶液为例:CH₃COOH⇌CH₃COO⁻ + H⁺(正向吸热)。

答案:
向右
@@减小
@@增大
@@增强
@@向右
@@增大
@@减小
@@增大
@@向左
@@增大
@@减小
@@减小
@@向右
@@减小
@@增大
@@减小
@@增大
@@增强
@@向右
@@增大
@@减小
@@增大
@@向左
@@增大
@@减小
@@减小
@@向右
@@减小
@@增大
微判断(正确的画“√”,错误的画“×”)
1. 改变条件,电离平衡正向移动,电离平衡常数一定增大。 ( )
2. 改变条件,电离平衡常数增大,电离平衡一定正向移动。 ( )
3. 相同条件下,可根据电离平衡常数的大小,比较弱电解质的相对强弱。 ( )
4. 同一弱电解质,浓度大的电离平衡常数大。 ( )
5. H₂CO₃ 的电离常数表达式为$K_{a}=\frac{c(H^{+})\cdot c(CO_{3}^{2 -})}{c(H_{2}CO_{3})}$。 ( )
1. 改变条件,电离平衡正向移动,电离平衡常数一定增大。 ( )
2. 改变条件,电离平衡常数增大,电离平衡一定正向移动。 ( )
3. 相同条件下,可根据电离平衡常数的大小,比较弱电解质的相对强弱。 ( )
4. 同一弱电解质,浓度大的电离平衡常数大。 ( )
5. H₂CO₃ 的电离常数表达式为$K_{a}=\frac{c(H^{+})\cdot c(CO_{3}^{2 -})}{c(H_{2}CO_{3})}$。 ( )
答案:
×
@@√
@@√
@@×
@@×
@@√
@@√
@@×
@@×
【例 1】 已知$0.1\ mol\cdot L^{-1}$的醋酸溶液中存在电离平衡:$CH_{3}COOH \longrightleftharpoons CH_{3}COO^{-} + H^{+}$,要使溶液中$\frac{c(H^{+})}{c(CH_{3}COOH)}$的比值增大,可以采取的措施是 ( )
A. 加少量烧碱溶液
B. 加$CH_{3}COONa(s)$
C. 加少量冰醋酸
D. 加水
A. 加少量烧碱溶液
B. 加$CH_{3}COONa(s)$
C. 加少量冰醋酸
D. 加水
答案:
D@@解析:$CH_{3}COOH\rightleftharpoons CH_{3}COO^{-}+H^{+}$,$K_{a}=\frac{c(CH_{3}COO^{-})\cdot c(H^{+})}{c(CH_{3}COOH)}$,则$\frac{c(H^{+})}{c(CH_{3}COOH)}=\frac{K_{a}}{c(CH_{3}COO^{-})}$。加少量烧碱溶液时,$OH^{-}$消耗了$H^{+}$,$c(H^{+})$降低,平衡右移,达到新平衡时$c(CH_{3}COO^{-})$增大,而$K_{a}$不变,故$\frac{c(H^{+})}{c(CH_{3}COOH)}$减小,A项错误;加$CH_{3}COONa(s)$,$c(H^{+})$减小,$c(CH_{3}COOH)$增大,其比值减小,B项错误;加入少量冰醋酸,$c(CH_{3}COO^{-})$增大,故$\frac{c(H^{+})}{c(CH_{3}COOH)}$比值减小,C项错误;加水稀释,平衡右移,但$c(CH_{3}COO^{-})$减小,故$\frac{c(H^{+})}{c(CH_{3}COOH)}$的比值增大,D项正确。
【变式训练】
1. 现有$0.1\ mol\cdot L^{-1}$氨水$10\ mL$,加蒸馏水稀释到$1\ L$后,下列变化中正确的是 ( )
①电离程度增大 ②$c(NH_{3}\cdot H_{2}O)$增大
③$NH_{4}^{+}$数目增多 ④$c(OH^{-})$增大 ⑤导电性增强 ⑥$\frac{c(NH_{4}^{+})}{c(NH_{3}\cdot H_{2}O)}$增大
A. ①②③
B. ①③⑤
C. ①③⑥
D. ②④⑥
1. 现有$0.1\ mol\cdot L^{-1}$氨水$10\ mL$,加蒸馏水稀释到$1\ L$后,下列变化中正确的是 ( )
①电离程度增大 ②$c(NH_{3}\cdot H_{2}O)$增大
③$NH_{4}^{+}$数目增多 ④$c(OH^{-})$增大 ⑤导电性增强 ⑥$\frac{c(NH_{4}^{+})}{c(NH_{3}\cdot H_{2}O)}$增大
A. ①②③
B. ①③⑤
C. ①③⑥
D. ②④⑥
答案:
C@@解析:氨水中的溶质属于弱电解质,存在电离平衡:$NH_{3}\cdot H_{2}O\rightleftharpoons NH_{4}^{+}+OH^{-}$,加水稀释,平衡正向移动,电离程度增大,$NH_{4}^{+}$和$OH^{-}$的物质的量增多,但$c(NH_{3}\cdot H_{2}O)$、$c(OH^{-})$均减小,溶液的导电性减弱,①③正确,②④⑤错误;由于$\frac{c(NH_{4}^{+})}{c(NH_{3}\cdot H_{2}O)}=\frac{n(NH_{4}^{+})}{n(NH_{3}\cdot H_{2}O)}$,加水稀释后,$n(NH_{4}^{+})$增大,$n(NH_{3}\cdot H_{2}O)$减小,$\frac{c(NH_{4}^{+})}{c(NH_{3}\cdot H_{2}O)}$增大,⑥正确。故选C。
【例 2】$25\ ^{\circ}C$时,根据三种酸的电离常数,下列判断正确的是 ( )
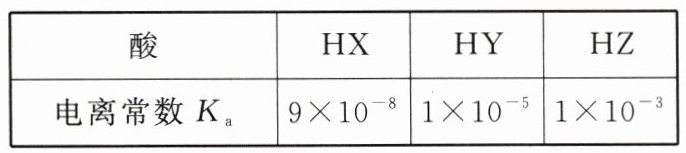
A. 三种酸的酸性强弱关系:$HX>HY>HZ$
B. $HZ$和$Y^{-}$不共存
C. $25\ ^{\circ}C$时,$0.1\ mol\cdot L^{-1}$的$HZ$溶液的$c(H^{+})=1×10^{-3}\ mol\cdot L^{-1}$
D. 相同温度下,$1\ mol\cdot L^{-1}\ HX$溶液的电离程度大于$0.1\ mol\cdot L^{-1}\ HX$溶液的电离程度

A. 三种酸的酸性强弱关系:$HX>HY>HZ$
B. $HZ$和$Y^{-}$不共存
C. $25\ ^{\circ}C$时,$0.1\ mol\cdot L^{-1}$的$HZ$溶液的$c(H^{+})=1×10^{-3}\ mol\cdot L^{-1}$
D. 相同温度下,$1\ mol\cdot L^{-1}\ HX$溶液的电离程度大于$0.1\ mol\cdot L^{-1}\ HX$溶液的电离程度
答案:
B@@解析:酸性越强,电离平衡常数越大,由表中数据可知,酸的电离平衡常数:$HZ>HY>HX$,则酸性强弱关系为$HZ>HY>HX$,A项错误;酸性:$HZ>HY$,由强酸制取弱酸规律可知,$HZ + Y^{-}=HY + Z^{-}$,则$HZ$和$Y^{-}$不共存,B项正确;$0.1mol\cdot L^{-1}$的$HZ$溶液中,$c(H^{+})=\sqrt{c\cdot K_{a}}=\sqrt{0.1\times1\times10^{-3}}mol\cdot L^{-1}=1\times10^{-2}mol\cdot L^{-1}$,C项错误;$HX$是弱酸,$1mol\cdot L^{-1}HX$溶液到$0.1mol\cdot L^{-1}HX$溶液,相当稀释,稀释能促进酸的电离,即酸的浓度越小,其电离程度越大,即$1mol\cdot L^{-1}HX$溶液的电离程度小于$0.1mol\cdot L^{-1}HX$溶液的电离程度,D项错误。
查看更多完整答案,请扫码查看


