2025年赢在微点轻松课堂微讲小本高中化学选择性必修1
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年赢在微点轻松课堂微讲小本高中化学选择性必修1 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第67页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
知识点一 盐溶液的酸碱性
1. 实验探究。
分别测定几种盐溶液的 pH,填写表格。
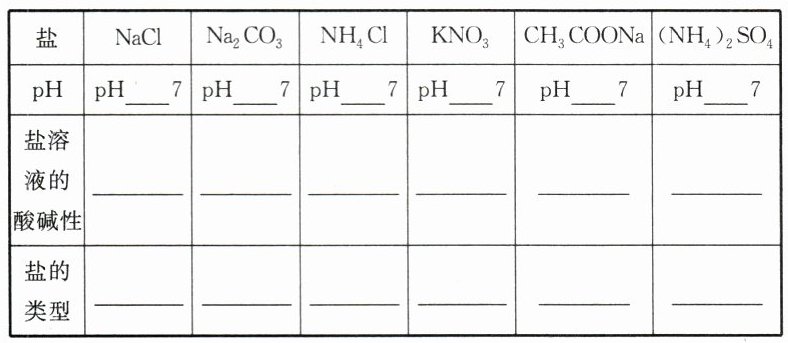
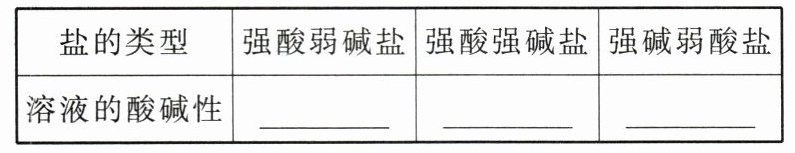
2. 实验结论。
|
【微思考】(1)NaNO₂ 有毒,其外观和食盐很相似且有咸味,可作为食品添加剂。如何用简单的方法鉴别 NaNO₂ 溶液、NaCl 溶液?
1. 实验探究。
分别测定几种盐溶液的 pH,填写表格。

2. 实验结论。
|

【微思考】(1)NaNO₂ 有毒,其外观和食盐很相似且有咸味,可作为食品添加剂。如何用简单的方法鉴别 NaNO₂ 溶液、NaCl 溶液?
答案:
=
@@>
@@<
@@=
@@>
@@<
@@中性
@@碱性
@@酸性
@@中性
@@碱性
@@酸性
@@强酸强碱盐
@@强碱弱酸盐
@@强酸弱碱盐
@@强酸强碱盐
@@强碱弱酸盐
@@强酸弱碱盐
@@酸性
@@中性
@@碱性
@@提示 (1)用pH试纸测溶液的pH,pH>7的是NaNO₂溶液,pH = 7的是NaCl溶液。
@@>
@@<
@@=
@@>
@@<
@@中性
@@碱性
@@酸性
@@中性
@@碱性
@@酸性
@@强酸强碱盐
@@强碱弱酸盐
@@强酸弱碱盐
@@强酸强碱盐
@@强碱弱酸盐
@@强酸弱碱盐
@@酸性
@@中性
@@碱性
@@提示 (1)用pH试纸测溶液的pH,pH>7的是NaNO₂溶液,pH = 7的是NaCl溶液。
知识点二 盐溶液呈现不同酸碱性的原因
分析不同类型的盐溶液中存在的各种离子及离子间的相互作用,填写表格:
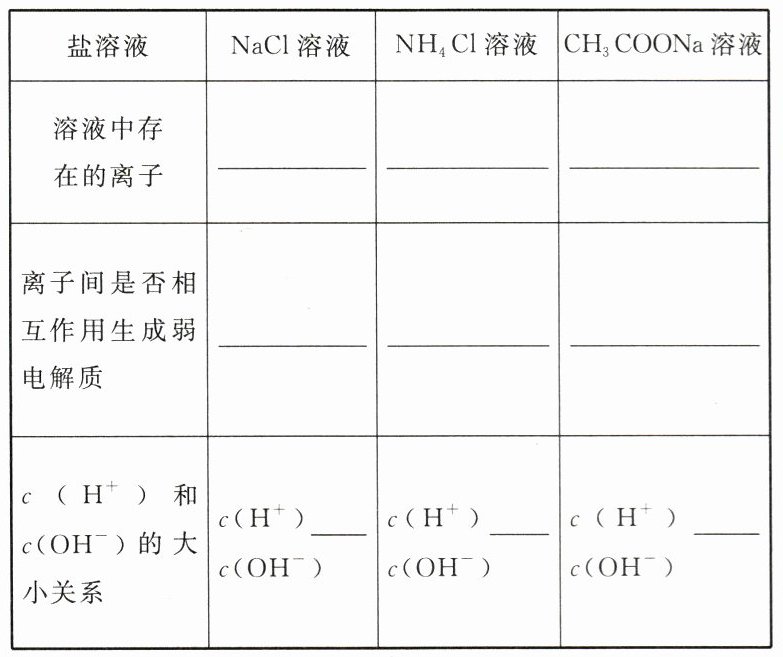
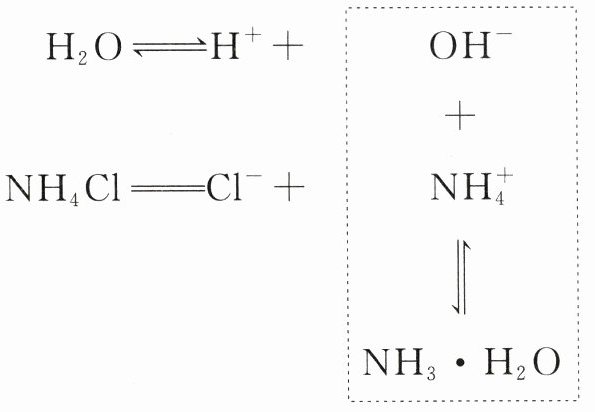
理论分析。
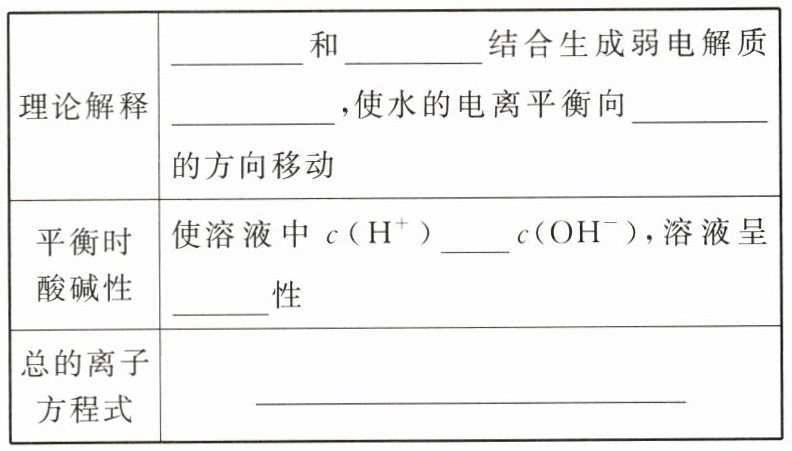
(1)NH₄Cl 溶液。
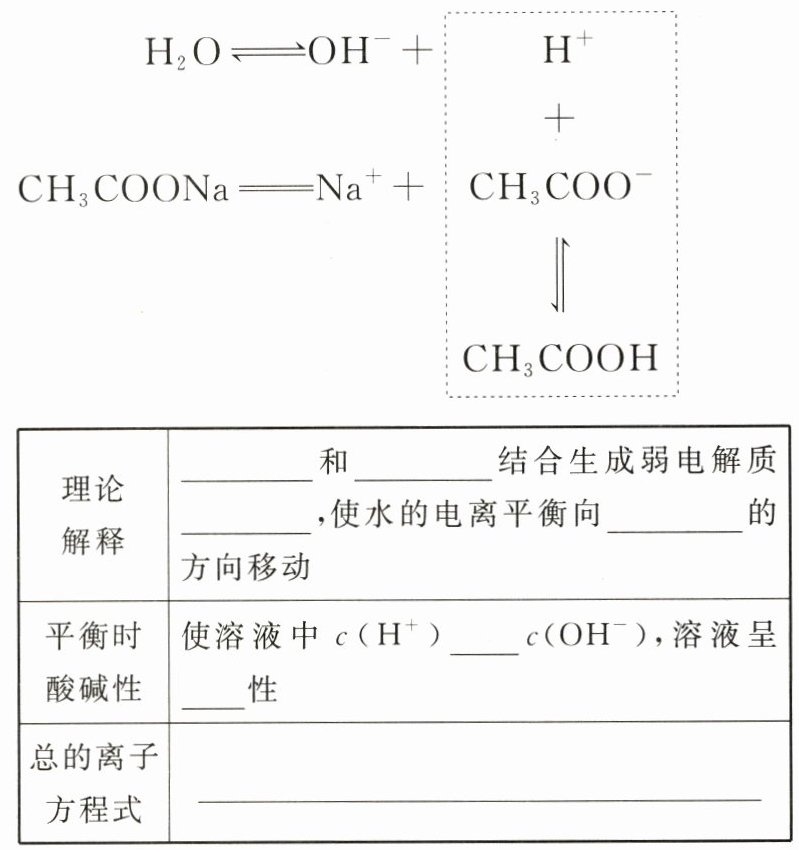
(2)CH₃COONa 溶液。
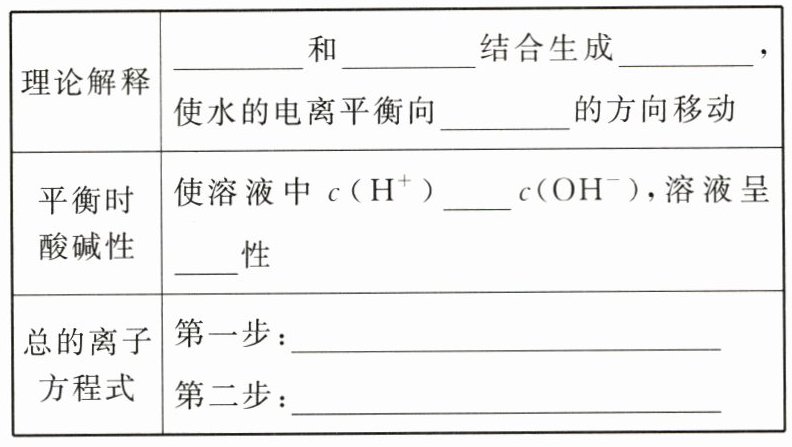
(3)Na₂CO₃ 溶液。

(4)NaCl 溶液。
H₂O⇌OH⁻ + H⁺,NaCl = Na⁺ + Cl⁻,
溶液中盐电离的离子不能与 H₂O 电离出的 H⁺ 或 OH⁻ 生成______。c(H⁺)____c(OH⁻),呈______。
【微思考】(2)怎样证明 Na₂CO₃ 溶液呈碱性是由 CO₃²⁻ 水解引起的?
分析不同类型的盐溶液中存在的各种离子及离子间的相互作用,填写表格:

理论分析。
(1)NH₄Cl 溶液。


(2)CH₃COONa 溶液。

(3)Na₂CO₃ 溶液。


(4)NaCl 溶液。
H₂O⇌OH⁻ + H⁺,NaCl = Na⁺ + Cl⁻,
溶液中盐电离的离子不能与 H₂O 电离出的 H⁺ 或 OH⁻ 生成______。c(H⁺)____c(OH⁻),呈______。
【微思考】(2)怎样证明 Na₂CO₃ 溶液呈碱性是由 CO₃²⁻ 水解引起的?
答案:
Na⁺、Cl⁻、OH⁻、H⁺
@@NH₄⁺、Cl⁻、OH⁻、H⁺
@@Na⁺ CH₃COO⁻、OH⁻、H⁺
@@否
@@NH₄⁺与OH⁻结合生成NH₃·H₂O
@@CH₃COO⁻与H⁺结合生成醋酸
@@=
@@>
@@<
@@NH₄⁺
@@OH⁻
@@NH₃·H₂O
@@电离
@@>
@@酸
@@NH₄⁺ + H₂O ⇌ NH₃·H₂O + H⁺
@@CH₃COO⁻
@@H⁺
@@CH₃COOH
@@电离
@@<
@@碱
@@CH₃COO⁻ + H₂O ⇌ CH₃COOH + OH⁻
@@CO₃²⁻
@@H⁺
@@HCO₃⁻
@@电离
@@<
@@碱
@@CO₃²⁻ + H₂O ⇌ HCO₃⁻ + OH⁻
@@HCO₃⁻ + H₂O ⇌ H₂CO₃ + OH⁻
@@弱电解质
@@=
@@中性
@@提示 (2)向Na₂CO₃溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液产生白色沉淀,且溶液的红色褪去,可说明Na₂CO₃溶液呈碱性是由CO₃²⁻水解引起的。
@@NH₄⁺、Cl⁻、OH⁻、H⁺
@@Na⁺ CH₃COO⁻、OH⁻、H⁺
@@否
@@NH₄⁺与OH⁻结合生成NH₃·H₂O
@@CH₃COO⁻与H⁺结合生成醋酸
@@=
@@>
@@<
@@NH₄⁺
@@OH⁻
@@NH₃·H₂O
@@电离
@@>
@@酸
@@NH₄⁺ + H₂O ⇌ NH₃·H₂O + H⁺
@@CH₃COO⁻
@@H⁺
@@CH₃COOH
@@电离
@@<
@@碱
@@CH₃COO⁻ + H₂O ⇌ CH₃COOH + OH⁻
@@CO₃²⁻
@@H⁺
@@HCO₃⁻
@@电离
@@<
@@碱
@@CO₃²⁻ + H₂O ⇌ HCO₃⁻ + OH⁻
@@HCO₃⁻ + H₂O ⇌ H₂CO₃ + OH⁻
@@弱电解质
@@=
@@中性
@@提示 (2)向Na₂CO₃溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液产生白色沉淀,且溶液的红色褪去,可说明Na₂CO₃溶液呈碱性是由CO₃²⁻水解引起的。
查看更多完整答案,请扫码查看


