第98页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
[典例1]已知某物质的化学式为$R_2CO_3$,相对分子质量是106,则R元素的相对原子质量是(
A.23 g
B.55 g
C.55
D.23
解析:设R元素的相对原子质量是x,则$2x + 12 + 16×3 = 106$,$x = 23$,相对原子质量是一个比值,单位为“1”,不是“g”。
答案:D
D
)。A.23 g
B.55 g
C.55
D.23
解析:设R元素的相对原子质量是x,则$2x + 12 + 16×3 = 106$,$x = 23$,相对原子质量是一个比值,单位为“1”,不是“g”。
答案:D
答案:
解:设R元素的相对原子质量是x。
2x + 12 + 16×3 = 106
2x + 12 + 48 = 106
2x + 60 = 106
2x = 106 - 60
2x = 46
x = 23
相对原子质量单位为“1”,故选D。
2x + 12 + 16×3 = 106
2x + 12 + 48 = 106
2x + 60 = 106
2x = 106 - 60
2x = 46
x = 23
相对原子质量单位为“1”,故选D。
[典例2]下列相对分子质量的计算正确的是(
A.$Cl_2$的相对分子质量= 36×2= 72
B.$Fe_3O_4$的相对分子质量= 56 + 3 + 16 + 4= 79
C.$KClO_3$的相对分子质量= 39 + 35.5 + 16= 90.5
D.$Ca(OH)_2$的相对分子质量= 40 + (16 + 1)×2= 74
解析:$Cl_2$的相对分子质量= 35.5×2= 71;$Fe_3O_4$的相对分子质量= 56×3 + 16×4= 232;$KClO_3$的相对分子质量= 39 + 35.5 + 16×3= 122.5;$Ca(OH)_2$的相对分子质量= 40 + (16 + 1)×2= 74。
答案:D
D
)。A.$Cl_2$的相对分子质量= 36×2= 72
B.$Fe_3O_4$的相对分子质量= 56 + 3 + 16 + 4= 79
C.$KClO_3$的相对分子质量= 39 + 35.5 + 16= 90.5
D.$Ca(OH)_2$的相对分子质量= 40 + (16 + 1)×2= 74
解析:$Cl_2$的相对分子质量= 35.5×2= 71;$Fe_3O_4$的相对分子质量= 56×3 + 16×4= 232;$KClO_3$的相对分子质量= 39 + 35.5 + 16×3= 122.5;$Ca(OH)_2$的相对分子质量= 40 + (16 + 1)×2= 74。
答案:D
答案:
【解析】:本题主要考查相对分子质量的计算。
A选项:$Cl_2$的相对分子质量应为氯原子的相对原子质量乘以原子个数,即$35.5 × 2 = 71$,而非$36 × 2 = 72$,故A选项错误。
B选项:$Fe_3O_4$的相对分子质量应为铁原子的相对原子质量乘以铁原子个数加上氧原子的相对原子质量乘以氧原子个数,即$56 × 3 + 16 × 4 = 232$,而非$56 + 3 + 16 + 4 = 79$,故B选项错误。
C选项:$KClO_3$的相对分子质量应为钾、氯、氧各元素的相对原子质量之和,即$39 + 35.5 + 16 × 3 = 122.5$,而非$39 + 35.5 + 16 = 90.5$,故C选项错误。
D选项:$Ca(OH)_2$的相对分子质量计算正确,为钙、氧、氢各元素的相对原子质量之和,即$40 + (16 + 1) × 2 = 74$,故D选项正确。
【答案】:D
A选项:$Cl_2$的相对分子质量应为氯原子的相对原子质量乘以原子个数,即$35.5 × 2 = 71$,而非$36 × 2 = 72$,故A选项错误。
B选项:$Fe_3O_4$的相对分子质量应为铁原子的相对原子质量乘以铁原子个数加上氧原子的相对原子质量乘以氧原子个数,即$56 × 3 + 16 × 4 = 232$,而非$56 + 3 + 16 + 4 = 79$,故B选项错误。
C选项:$KClO_3$的相对分子质量应为钾、氯、氧各元素的相对原子质量之和,即$39 + 35.5 + 16 × 3 = 122.5$,而非$39 + 35.5 + 16 = 90.5$,故C选项错误。
D选项:$Ca(OH)_2$的相对分子质量计算正确,为钙、氧、氢各元素的相对原子质量之和,即$40 + (16 + 1) × 2 = 74$,故D选项正确。
【答案】:D
[典例3]食醋是生活中常用的调味剂,其主要成分乙酸的结构模型图如图所示。下列说法不正确的是(
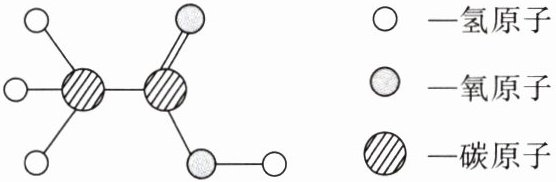
(注:图中○表示氢原子,○表示氧原子,●表示碳原子)
A.乙酸的化学式为$CH_3COOH$
B.乙酸中碳元素和氢元素的质量比为6:1
C.乙酸由2个碳原子、4个氢原子和2个氧原子构成
D.乙酸中氧元素的质量分数最大
解析:由图可知,乙酸的化学式为$CH_3COOH$,A正确;乙酸中碳元素和氢元素的质量比为$(2×12):4 = 6:1$,B正确;1个乙酸分子是由2个碳原子、4个氢原子和2个氧原子构成的,C错误;乙酸中碳元素、氢元素、氧元素的质量比为$(2×12):4:(2×16)= 6:1:8$,所以乙酸中氧元素的质量分数最大,D正确。
答案:C
C
)。
(注:图中○表示氢原子,○表示氧原子,●表示碳原子)
A.乙酸的化学式为$CH_3COOH$
B.乙酸中碳元素和氢元素的质量比为6:1
C.乙酸由2个碳原子、4个氢原子和2个氧原子构成
D.乙酸中氧元素的质量分数最大
解析:由图可知,乙酸的化学式为$CH_3COOH$,A正确;乙酸中碳元素和氢元素的质量比为$(2×12):4 = 6:1$,B正确;1个乙酸分子是由2个碳原子、4个氢原子和2个氧原子构成的,C错误;乙酸中碳元素、氢元素、氧元素的质量比为$(2×12):4:(2×16)= 6:1:8$,所以乙酸中氧元素的质量分数最大,D正确。
答案:C
答案:
【解析】:
A选项:从结构模型图中可以看出,乙酸分子由2个碳原子、4个氢原子和2个氧原子构成,其化学式可表示为$CH_3COOH$(也可写成$C_2H_4O_2$),所以A选项正确。
B选项:化合物中各元素质量比等于各原子的相对原子质量与原子个数乘积之比。乙酸中碳元素和氢元素的质量比为$(12×2):(1×4)=24:4 = 6:1$,所以B选项正确。
C选项:乙酸是由乙酸分子构成的,一个乙酸分子是由2个碳原子、4个氢原子和2个氧原子构成的,不能直接说乙酸由2个碳原子、4个氢原子和2个氧原子构成,所以C选项错误。
D选项:计算乙酸中碳元素、氢元素、氧元素的质量比为$(12×2):(1×4):(16×2)=24:4:32 = 6:1:8$,可见氧元素的质量占比最大,所以乙酸中氧元素的质量分数最大,D选项正确。
【答案】:C
A选项:从结构模型图中可以看出,乙酸分子由2个碳原子、4个氢原子和2个氧原子构成,其化学式可表示为$CH_3COOH$(也可写成$C_2H_4O_2$),所以A选项正确。
B选项:化合物中各元素质量比等于各原子的相对原子质量与原子个数乘积之比。乙酸中碳元素和氢元素的质量比为$(12×2):(1×4)=24:4 = 6:1$,所以B选项正确。
C选项:乙酸是由乙酸分子构成的,一个乙酸分子是由2个碳原子、4个氢原子和2个氧原子构成的,不能直接说乙酸由2个碳原子、4个氢原子和2个氧原子构成,所以C选项错误。
D选项:计算乙酸中碳元素、氢元素、氧元素的质量比为$(12×2):(1×4):(16×2)=24:4:32 = 6:1:8$,可见氧元素的质量占比最大,所以乙酸中氧元素的质量分数最大,D选项正确。
【答案】:C
[典例4]儿童缺锌会引起食欲不振、发育不良等症状。如图为某补锌口服液说明书的部分信息,图中葡萄糖酸锌的化学式已不完整,请根据相关信息回答下列问题。
| 补锌口服液 | |
| 主要成分: | 葡萄糖酸锌 |
| 化学式: | $C_{12}H_{□}O_{14}Zn$ |
| 含锌: | 5.0 mg/支 |
| 质量: | 10.0 g/支 |

(1)葡萄糖酸锌的相对分子质量是455,则葡萄糖酸锌的化学式中氢原子右下角的数字为______。
(2)若儿童1 kg体重每日需要0.5 mg锌,每天从食物中只能摄入所需锌的一半。体重为20 kg的儿童,理论上一天还需服该口服液______支。
解析:(1)葡萄糖酸锌的相对分子质量是455,设H的原子个数为x,则$12×12 + 1× x + 16×14 + 65 = 455$,解得$x = 22$。
(2)儿童1 kg体重每日需要0.5 mg锌,则体重为20 kg的儿童每天需要锌的质量为$0.5\ mg/kg×20\ kg= 10\ mg$;每天从食物中只能摄入所需锌的一半,则每天从该口服液中摄入锌的质量为$10\ mg×\frac{1}{2}= 5\ mg$;而每支口服液中含锌5.0 mg,故体重为20 kg的儿童,每天还需服该口服液1支。
答案:(1)
| 补锌口服液 | |
| 主要成分: | 葡萄糖酸锌 |
| 化学式: | $C_{12}H_{□}O_{14}Zn$ |
| 含锌: | 5.0 mg/支 |
| 质量: | 10.0 g/支 |

(1)葡萄糖酸锌的相对分子质量是455,则葡萄糖酸锌的化学式中氢原子右下角的数字为______。
(2)若儿童1 kg体重每日需要0.5 mg锌,每天从食物中只能摄入所需锌的一半。体重为20 kg的儿童,理论上一天还需服该口服液______支。
解析:(1)葡萄糖酸锌的相对分子质量是455,设H的原子个数为x,则$12×12 + 1× x + 16×14 + 65 = 455$,解得$x = 22$。
(2)儿童1 kg体重每日需要0.5 mg锌,则体重为20 kg的儿童每天需要锌的质量为$0.5\ mg/kg×20\ kg= 10\ mg$;每天从食物中只能摄入所需锌的一半,则每天从该口服液中摄入锌的质量为$10\ mg×\frac{1}{2}= 5\ mg$;而每支口服液中含锌5.0 mg,故体重为20 kg的儿童,每天还需服该口服液1支。
答案:(1)
22
(2)1
答案:
(1)解:设葡萄糖酸锌化学式中氢原子右下角的数字为x。
根据相对分子质量的计算式:12×12 + 1×x + 16×14 + 65 = 455
即144 + x + 224 + 65 = 455
x + 433 = 455
x = 455 - 433 = 22
(2)解:体重为20 kg的儿童每日需锌量:0.5 mg/kg×20 kg = 10 mg
每日需从口服液摄入锌量:10 mg×(1/2) = 5 mg
需服用口服液支数:5 mg÷5.0 mg/支 = 1支
答案:
(1)22
(2)1
(1)解:设葡萄糖酸锌化学式中氢原子右下角的数字为x。
根据相对分子质量的计算式:12×12 + 1×x + 16×14 + 65 = 455
即144 + x + 224 + 65 = 455
x + 433 = 455
x = 455 - 433 = 22
(2)解:体重为20 kg的儿童每日需锌量:0.5 mg/kg×20 kg = 10 mg
每日需从口服液摄入锌量:10 mg×(1/2) = 5 mg
需服用口服液支数:5 mg÷5.0 mg/支 = 1支
答案:
(1)22
(2)1
查看更多完整答案,请扫码查看


