第59页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
1. 原子得失电子形成离子后的质子数、电子数、化学性质及电子层数是否改变?
解:原子得失电子形成离子后,质子数
2. 离子与原子都是构成物质的粒子,两者有何异同?
|粒子|原子|离子|
| | |阳离子|阴离子|
|构成粒子间的关系|质子数
|电性|
|粒子符号表示|如钠、硫表示为Na、S|如钠离子表示为$Na^+$|如硫离子表示为$S^{2-}$|
|相互转化关系|阳离子$\xrightleftharpoons[失电子]{得电子}原子\xrightleftharpoons[失电子]{得电子}$阴离子|

解:原子得失电子形成离子后,质子数
不变
;电子数改变
;化学性质改变
;电子层数可能改变(原子失去电子形成阳离子时电子层数可能减少,原子得到电子形成阴离子时电子层数不变)
。2. 离子与原子都是构成物质的粒子,两者有何异同?
|粒子|原子|离子|
| | |阳离子|阴离子|
|构成粒子间的关系|质子数
等于
核外电子数|质子数大于
核外电子数|质子数小于
核外电子数||电性|
不显
电性|显正
电性|显负
电性||粒子符号表示|如钠、硫表示为Na、S|如钠离子表示为$Na^+$|如硫离子表示为$S^{2-}$|
|相互转化关系|阳离子$\xrightleftharpoons[失电子]{得电子}原子\xrightleftharpoons[失电子]{得电子}$阴离子|

答案:
1. 解:原子得失电子形成离子后,质子数不变;电子数改变;化学性质改变;电子层数可能改变(原子失去电子形成阳离子时电子层数可能减少,原子得到电子形成阴离子时电子层数不变)。
2. 解:
|粒子|原子|离子|
|----|----|----|
| | |阳离子|阴离子|
|构成粒子间的关系|质子数等于核外电子数|质子数大于核外电子数|质子数小于核外电子数|
|电性|不显电性|显正电性|显负电性|
|粒子符号表示|如钠、硫表示为Na、S|如钠离子表示为$Na^+$|如硫离子表示为$S^{2-}$|
|相互转化关系|阳离子$\xrightleftharpoons[失电子]{得电子}原子\xrightleftharpoons[失电子]{得电子}$阴离子|
2. 解:
|粒子|原子|离子|
|----|----|----|
| | |阳离子|阴离子|
|构成粒子间的关系|质子数等于核外电子数|质子数大于核外电子数|质子数小于核外电子数|
|电性|不显电性|显正电性|显负电性|
|粒子符号表示|如钠、硫表示为Na、S|如钠离子表示为$Na^+$|如硫离子表示为$S^{2-}$|
|相互转化关系|阳离子$\xrightleftharpoons[失电子]{得电子}原子\xrightleftharpoons[失电子]{得电子}$阴离子|
[典例1]钠与氯气反应生成氯化钠的示意图如下。下列有关说法正确的是(

A.氯化钠固体由分子构成
B.反应中1个钠原子失去1个电子,形成相对稳定结构
C.氯原子核外有2个电子层
D.反应中Cl生成$Cl^-$,证明化学反应中质子数发生了改变
解析:氯化钠固体是由钠离子和氯离子构成的,故A错误;钠原子的质子数为11,核外电子数为11,由原子核外电子的排布规律可知,钠原子的核外电子排布为2、8、1,所以在反应中1个钠原子失去1个电子,形成相对稳定结构,故B正确;氯原子的质子数为17,核外电子数为17,由原子核外电子的排布规律可知,氯原子的核外电子排布为2、8、7,所以氯原子核外有3个电子层,故C错误;Cl、$Cl^-$的质子数均为17,化学反应中质子数不变,故D错误。
答案:B
B
)。
A.氯化钠固体由分子构成
B.反应中1个钠原子失去1个电子,形成相对稳定结构
C.氯原子核外有2个电子层
D.反应中Cl生成$Cl^-$,证明化学反应中质子数发生了改变
解析:氯化钠固体是由钠离子和氯离子构成的,故A错误;钠原子的质子数为11,核外电子数为11,由原子核外电子的排布规律可知,钠原子的核外电子排布为2、8、1,所以在反应中1个钠原子失去1个电子,形成相对稳定结构,故B正确;氯原子的质子数为17,核外电子数为17,由原子核外电子的排布规律可知,氯原子的核外电子排布为2、8、7,所以氯原子核外有3个电子层,故C错误;Cl、$Cl^-$的质子数均为17,化学反应中质子数不变,故D错误。
答案:B
答案:
【解析】:
A. 氯化钠是由钠离子和氯离子构成的,而不是由分子构成,故A选项说法错误。
B. 钠原子的质子数为11,核外电子数为11,核外电子排布为2、8、1,在反应中1个钠原子失去1个电子,形成相对稳定结构,故B选项说法正确。
C. 氯原子的质子数为17,核外电子数为17,核外电子排布为2、8、7,所以氯原子核外有3个电子层,而不是2个电子层,故C选项说法错误。
D. 反应中Cl生成$Cl^-$,是氯原子得到1个电子形成的,化学反应中质子数不变,故D选项说法错误。
【答案】:B
A. 氯化钠是由钠离子和氯离子构成的,而不是由分子构成,故A选项说法错误。
B. 钠原子的质子数为11,核外电子数为11,核外电子排布为2、8、1,在反应中1个钠原子失去1个电子,形成相对稳定结构,故B选项说法正确。
C. 氯原子的质子数为17,核外电子数为17,核外电子排布为2、8、7,所以氯原子核外有3个电子层,而不是2个电子层,故C选项说法错误。
D. 反应中Cl生成$Cl^-$,是氯原子得到1个电子形成的,化学反应中质子数不变,故D选项说法错误。
【答案】:B
[典例2]在下列示意图表示的粒子中,属于原子的有
① ② ③ ④ ⑤ ⑥
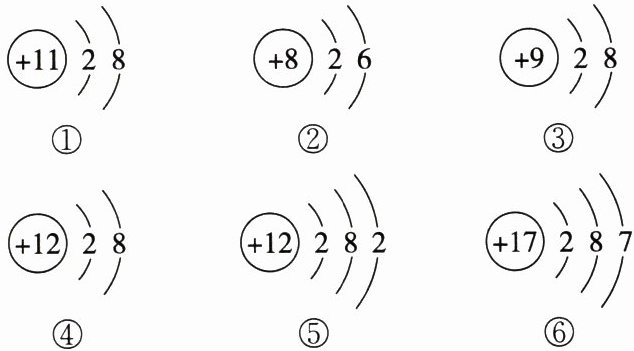
通过上图可以总结出,原子和离子的区别在于:
(1)
(2)
②⑤⑥
(填序号,下同),属于阴离子的有③
,属于阳离子的有①④
。① ② ③ ④ ⑤ ⑥

通过上图可以总结出,原子和离子的区别在于:
(1)
原子中质子数(或核电荷数)等于核外电子数,而离子中不相等
。(2)
原子不显电性,离子显电性
。
答案:
【解析】:
首先,我们需要知道原子、阴离子和阳离子的定义和特征。
原子:质子数等于核外电子数。
阴离子:质子数小于核外电子数。
阳离子:质子数大于核外电子数。
接下来,我们逐一分析每个粒子的示意图:
①质子数为11,核外电子数为$2+8=10$,质子数大于核外电子数,所以①是阳离子。
②质子数为8,核外电子数为$2+6=8$,质子数等于核外电子数,所以②是原子。
③质子数为9,核外电子数为$2+8=10$,质子数小于核外电子数,所以③是阴离子。
④质子数为12,核外电子数为$2+8=10$,质子数大于核外电子数,所以④是阳离子。
⑤质子数为12,核外电子数为$2+8+2=12$,质子数等于核外电子数,所以⑤是原子。
⑥质子数为17,核外电子数为$2+8+7=17$,质子数等于核外电子数,所以⑥是原子。
通过上述分析,我们可以得出以下结论:
属于原子的有:②⑤⑥。
属于阴离子的有:③。
属于阳离子的有:①④。
原子和离子的区别在于:
(1)原子中质子数(或核电荷数)等于核外电子数,而离子中不相等。
(2)原子不显电性,离子显电性。
【答案】:
属于原子的有:②⑤⑥
属于阴离子的有:③
属于阳离子的有:①④
原子和离子的区别在于:
(1)原子中质子数(或核电荷数)等于核外电子数,而离子中不相等。
(2)原子不显电性,离子显电性。
首先,我们需要知道原子、阴离子和阳离子的定义和特征。
原子:质子数等于核外电子数。
阴离子:质子数小于核外电子数。
阳离子:质子数大于核外电子数。
接下来,我们逐一分析每个粒子的示意图:
①质子数为11,核外电子数为$2+8=10$,质子数大于核外电子数,所以①是阳离子。
②质子数为8,核外电子数为$2+6=8$,质子数等于核外电子数,所以②是原子。
③质子数为9,核外电子数为$2+8=10$,质子数小于核外电子数,所以③是阴离子。
④质子数为12,核外电子数为$2+8=10$,质子数大于核外电子数,所以④是阳离子。
⑤质子数为12,核外电子数为$2+8+2=12$,质子数等于核外电子数,所以⑤是原子。
⑥质子数为17,核外电子数为$2+8+7=17$,质子数等于核外电子数,所以⑥是原子。
通过上述分析,我们可以得出以下结论:
属于原子的有:②⑤⑥。
属于阴离子的有:③。
属于阳离子的有:①④。
原子和离子的区别在于:
(1)原子中质子数(或核电荷数)等于核外电子数,而离子中不相等。
(2)原子不显电性,离子显电性。
【答案】:
属于原子的有:②⑤⑥
属于阴离子的有:③
属于阳离子的有:①④
原子和离子的区别在于:
(1)原子中质子数(或核电荷数)等于核外电子数,而离子中不相等。
(2)原子不显电性,离子显电性。
查看更多完整答案,请扫码查看


