第87页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
10. 废旧计算机的某些部件中含有锌、铁、铜,回收金属时经物理方法初步处理后,再与足量的稀盐酸充分反应,过滤,则剩余的固体中一定不含有的金属是(已知铜不与稀盐酸反应)(
A.铜、锌
B.铜
C.锌、铁
D.铁、铜
C
)A.铜、锌
B.铜
C.锌、铁
D.铁、铜
答案:
C 【解析】锌、铁、铜中锌和铁能与稀盐酸反应,稀盐酸足量,则过滤后剩余固体中一定不含锌和铁,故选 C。
11. 传统文化情境 艺术与特色技能 古人在保护金属资源方面尽显智慧。


(1)图1为清代白铜烤蓝手炉,经“烤蓝”其表面形成一层致密的氧化膜,其防锈原理是
(2)图2为唐鎏金铁芯铜龙,“鎏金”指的是将金溶于汞制的“金汞漆”,涂于器物表面,加热除汞,留下金附着在器物表面,这体现金的化学性质
(3)当今社会,回收利用废旧金属是保护金属资源的有效途径之一,这样做的意义是


(1)图1为清代白铜烤蓝手炉,经“烤蓝”其表面形成一层致密的氧化膜,其防锈原理是
隔绝氧气(或空气)和水蒸气
。(2)图2为唐鎏金铁芯铜龙,“鎏金”指的是将金溶于汞制的“金汞漆”,涂于器物表面,加热除汞,留下金附着在器物表面,这体现金的化学性质
不活泼
。(3)当今社会,回收利用废旧金属是保护金属资源的有效途径之一,这样做的意义是
能节约金属矿物资源(合理即可)
。
答案:
(1)隔绝氧气(或空气)和水蒸气
(2)不活泼
(3)能节约金属矿物资源(合理即可)
(1)隔绝氧气(或空气)和水蒸气
(2)不活泼
(3)能节约金属矿物资源(合理即可)
12. (中考新考法·项目式学习)学校实验室的铁架台有生锈迹象,兴趣小组的同学为铁架台的除锈翻新设计方案并进行如下项目式学习活动。
任务一:制定方案
同学们经过讨论,制定了先除锈再防护的方案,并设计如下步骤:
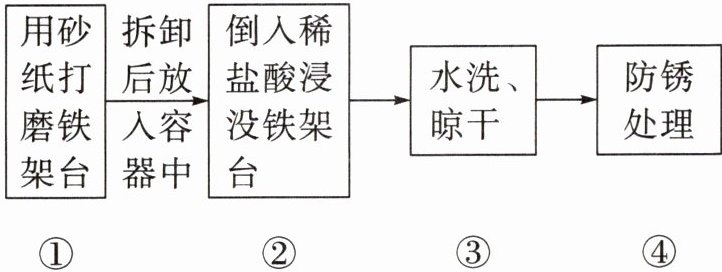
(1)进行步骤①的目的是
任务二:进行实验
(2)向容器内加入稀盐酸后,可以除去铁锈,生成氯化铁和水,该反应的化学方程式为
(3)在不影响后续使用的情况下,请写出一种防锈措施
任务三:实验反思
(4)有同学提出浸泡时间不宜过长,否则会损坏铁架台,其原因是
任务一:制定方案
同学们经过讨论,制定了先除锈再防护的方案,并设计如下步骤:

(1)进行步骤①的目的是
除去铁架台表面的部分铁锈与污物
。任务二:进行实验
(2)向容器内加入稀盐酸后,可以除去铁锈,生成氯化铁和水,该反应的化学方程式为
$Fe_{2}O_{3}+6HCl=2FeCl_{3}+3H_{2}O$
。(3)在不影响后续使用的情况下,请写出一种防锈措施
涂上防锈漆(合理即可)
。任务三:实验反思
(4)有同学提出浸泡时间不宜过长,否则会损坏铁架台,其原因是
浸泡时间过长,稀盐酸会进一步与铁反应,从而腐蚀铁架台
。
答案:
(1)除去铁架台表面的部分铁锈与污物
(2)$Fe_{2}O_{3}+6HCl=2FeCl_{3}+3H_{2}O$
(3)涂上防锈漆(合理即可)
(4)浸泡时间过长,稀盐酸会进一步与铁反应,从而腐蚀铁架台
(1)除去铁架台表面的部分铁锈与污物
(2)$Fe_{2}O_{3}+6HCl=2FeCl_{3}+3H_{2}O$
(3)涂上防锈漆(合理即可)
(4)浸泡时间过长,稀盐酸会进一步与铁反应,从而腐蚀铁架台
13. 日常生活情境 厨房用品 不锈钢锅一般不会发生锈蚀,但小明发现有菜汤残留时,接触菜汤的部位也会发生锈蚀,而普通铁锅沾水就会生锈。于是联想到金属锈蚀的快慢可能和盐水浓度及材料有关,设计了如下实验。
【进行实验】(1)取大小、形状相同的不锈钢丝和铁丝各4根,利用如图装置进行探究:

【实验分析】(2)实验中,小明发现注射器活塞从50毫升刻度处逐渐移动到40毫升处就静止了,这是因为
【进行实验】(1)取大小、形状相同的不锈钢丝和铁丝各4根,利用如图装置进行探究:

【实验分析】(2)实验中,小明发现注射器活塞从50毫升刻度处逐渐移动到40毫升处就静止了,这是因为
注射器中氧气被消耗完且氧气约占空气总体积的$\frac {1}{5}$
。(3)通过该实验,请你写出一条日常生活中保护不锈钢锅的办法 使用时应避免长时间接触高浓度盐水(合理即可)
。
答案:
(1)时间
(2)注射器中氧气被消耗完且氧气约占空气总体积的$\frac {1}{5}$
(3)使用时应避免长时间接触高浓度盐水(合理即可)
(1)时间
(2)注射器中氧气被消耗完且氧气约占空气总体积的$\frac {1}{5}$
(3)使用时应避免长时间接触高浓度盐水(合理即可)
14. 生产情境 废液处理 某工厂为处理含铜废液(主要成分为$CuSO_4、$$FeSO_4、$$ZnSO_4),$并从中提取硫酸铜,设计如图所示工艺流程(铁与硫酸锌溶液不反应)。

(1)在反应器中充分反应后,排出的尾液主要成分有 (
(2)净化器中加入适量稀硫酸的目的是
(3)焙烧炉中需要不断鼓入氧气的原因是
(4)酸浸槽中发生反应的化学方程式为
(5)该工艺的价值在于

(1)在反应器中充分反应后,排出的尾液主要成分有 (
$FeSO_{4}$、$ZnSO_{4}$
)。(2)净化器中加入适量稀硫酸的目的是
除去过量的废铁
。(3)焙烧炉中需要不断鼓入氧气的原因是
使铜完全转化为氧化铜
。(4)酸浸槽中发生反应的化学方程式为
$CuO+H_{2}SO_{4}=CuSO_{4}+H_{2}O$
。(5)该工艺的价值在于
废物利用(合理即可)
。
答案:
(1)$FeSO_{4}$、$ZnSO_{4}$
(2)除去过量的废铁
(3)使铜完全转化为氧化铜
(4)$CuO+H_{2}SO_{4}=CuSO_{4}+H_{2}O$
(5)废物利用(合理即可)
(1)$FeSO_{4}$、$ZnSO_{4}$
(2)除去过量的废铁
(3)使铜完全转化为氧化铜
(4)$CuO+H_{2}SO_{4}=CuSO_{4}+H_{2}O$
(5)废物利用(合理即可)
查看更多完整答案,请扫码查看


