第101页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
1. 劳育 农业生产活动 小华参加农业实践活动时,在室温下(20℃)配制溶质质量分数为10%的KCl溶液用于作物无土栽培,KCl的溶解度曲线如图所示(水的密度以$1g·mL⁻^1$计)。下列说法正确的是 (
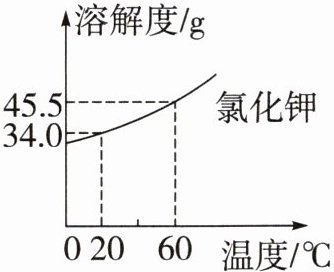
A.所配营养液为室温下KCl的饱和溶液
B.升温,营养液的溶质质量分数不变
C.降温,营养液中一定有KCl晶体析出
D.取50gKCl固体,加水500mL可将其配制为10%的营养液
B
)
A.所配营养液为室温下KCl的饱和溶液
B.升温,营养液的溶质质量分数不变
C.降温,营养液中一定有KCl晶体析出
D.取50gKCl固体,加水500mL可将其配制为10%的营养液
答案:
B
2. (黑白卷)传统文化情境 经典篇目 《水经注》中描述:“入汤口四十三里,有石,煮以为盐……水竭盐成。”“煮以为盐”得到的粗盐中含有氯化钠和氯化钾,这两种物质的溶解度曲线如图所示。下列说法正确的是 (
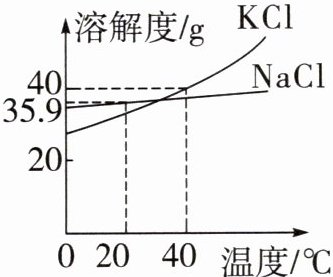
A.“煮以为盐”时搅拌能增大氯化钠的溶解度
B.“煮以为盐”过程中盐的溶质质量分数先变大后不变
C.“水竭盐成”后得到的主要是KCl晶体
D.“水竭盐成”所用方法是降温结晶
B
)
A.“煮以为盐”时搅拌能增大氯化钠的溶解度
B.“煮以为盐”过程中盐的溶质质量分数先变大后不变
C.“水竭盐成”后得到的主要是KCl晶体
D.“水竭盐成”所用方法是降温结晶
答案:
B 【解析】“煮以为盐”时搅拌可防止液滴飞溅,不能增大氯化钠的溶解度,A 说法错误;“煮以为盐”过程中溶剂质量减小,溶质质量分数变大,当溶液达到饱和后,继续蒸发水分,就会有晶体析出,此后溶质质量分数不变,B 说法正确;“水竭盐成”后得到的主要是氯化钾和氯化钠的固体混合物,C 说法错误;“水竭盐成”所用方法是蒸发结晶,D 说法错误。
3. 趣味实验 自制蛋壳水晶 同学们在实验室制作“蛋壳水晶”工艺品,如图。硫酸铜的溶解度数据如表所示,下列相关说法正确的是(
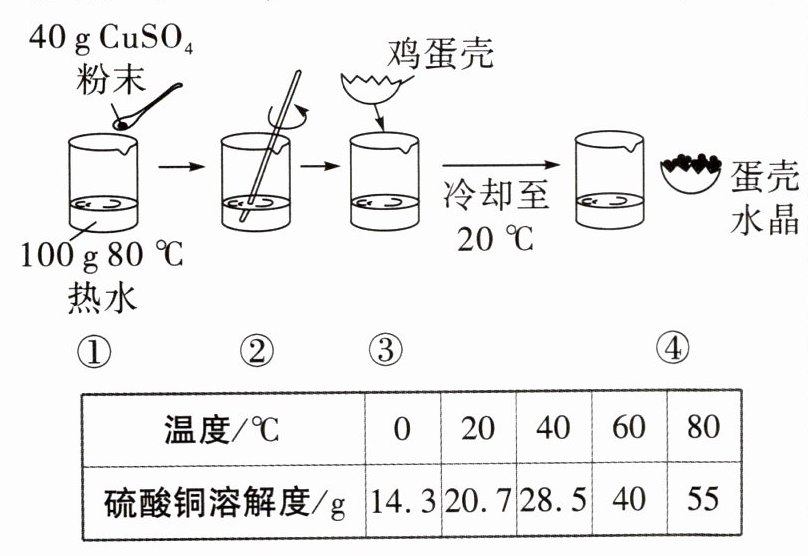
A.①中热水的主要作用是加快硫酸铜粉末的溶解
B.②中得到的溶液是硫酸铜的不饱和溶液
C.④中溶液的溶质质量分数约为28.6%
D.该实验的原理是硫酸铜的溶解度随温度的降低而增大
B
)
A.①中热水的主要作用是加快硫酸铜粉末的溶解
B.②中得到的溶液是硫酸铜的不饱和溶液
C.④中溶液的溶质质量分数约为28.6%
D.该实验的原理是硫酸铜的溶解度随温度的降低而增大
答案:
B
4. 日常生活情境 融雪剂 氯盐融雪剂的种类繁多,其成分主要是氯化钠、氯化钙、氯化镁中的一种或多种。下表是这三种物质的溶解度表。

(1)在通常情况下,纯水的冰点为0℃,20%的氯化钠溶液的冰点为-10℃,因此抛撒含有氯化钠的“融雪剂”可快速融雪的原因可能是
(2)同学们想要了解等质量的三种物质饱和溶液的融雪效果,现要在20℃时配制符合要求的这三种溶液,则需要固体质量最小的是
(3)将(2)中配制好的三种溶液分别升温至30℃,所得溶液的溶质质量分数由大到小的关系为

(1)在通常情况下,纯水的冰点为0℃,20%的氯化钠溶液的冰点为-10℃,因此抛撒含有氯化钠的“融雪剂”可快速融雪的原因可能是
氯化钠溶于水形成的氯化钠溶液冰点更低
。(2)同学们想要了解等质量的三种物质饱和溶液的融雪效果,现要在20℃时配制符合要求的这三种溶液,则需要固体质量最小的是
NaCl(或氯化钠)
。(3)将(2)中配制好的三种溶液分别升温至30℃,所得溶液的溶质质量分数由大到小的关系为
CaCl₂>MgCl₂>NaCl
。
答案:
(1)氯化钠溶于水形成的氯化钠溶液冰点更低
(2)NaCl(或氯化钠)
(3)CaCl₂>MgCl₂>NaCl 【解析】
(1)氯化钠溶于水形成的氯化钠溶液冰点更低,因此可抛撒含有氯化钠的“融雪剂”快速融雪。
(2)分析表格数据,可知在 20℃时三种物质的溶解度大小关系为氯化钙>氯化镁>氯化钠,因此要在 20℃时配制符合要求的这三种溶液,需要固体质量最小的是氯化钠。
(3)三种物质的溶解度在 0~30℃时均随温度升高而增大,将 20℃时三种物质的饱和溶液分别升温至 30℃,溶质质量分数不变,与 20℃时三种物质饱和溶液溶质质量分数相等,根据饱和溶液溶质质量分数计算公式$\frac {S}{100g+S}×100\% $,以及 20℃时溶解度:氯化钙>氯化镁>氯化钠,可知所得溶液中溶质质量分数大小关系为氯化钙>氯化镁>氯化钠。 难点突破 将 20℃等质量的三种物质的饱和溶液分别升温至 30℃,对溶液中溶质质量分数判断时,首先要确定升温后三种物质的状态,若三种物质溶液状态均变为不饱和溶液,则三种物质的溶质质量分数不变,根据饱和溶液溶质质量分数的计算公式以及 20℃时三种物质的溶解度进行计算。
(1)氯化钠溶于水形成的氯化钠溶液冰点更低
(2)NaCl(或氯化钠)
(3)CaCl₂>MgCl₂>NaCl 【解析】
(1)氯化钠溶于水形成的氯化钠溶液冰点更低,因此可抛撒含有氯化钠的“融雪剂”快速融雪。
(2)分析表格数据,可知在 20℃时三种物质的溶解度大小关系为氯化钙>氯化镁>氯化钠,因此要在 20℃时配制符合要求的这三种溶液,需要固体质量最小的是氯化钠。
(3)三种物质的溶解度在 0~30℃时均随温度升高而增大,将 20℃时三种物质的饱和溶液分别升温至 30℃,溶质质量分数不变,与 20℃时三种物质饱和溶液溶质质量分数相等,根据饱和溶液溶质质量分数计算公式$\frac {S}{100g+S}×100\% $,以及 20℃时溶解度:氯化钙>氯化镁>氯化钠,可知所得溶液中溶质质量分数大小关系为氯化钙>氯化镁>氯化钠。 难点突破 将 20℃等质量的三种物质的饱和溶液分别升温至 30℃,对溶液中溶质质量分数判断时,首先要确定升温后三种物质的状态,若三种物质溶液状态均变为不饱和溶液,则三种物质的溶质质量分数不变,根据饱和溶液溶质质量分数的计算公式以及 20℃时三种物质的溶解度进行计算。
5. 在新能源的背景下锂离子电池需求激增,工业上利用锂辉石制备锂离子的关键原料碳酸锂的流程如图:
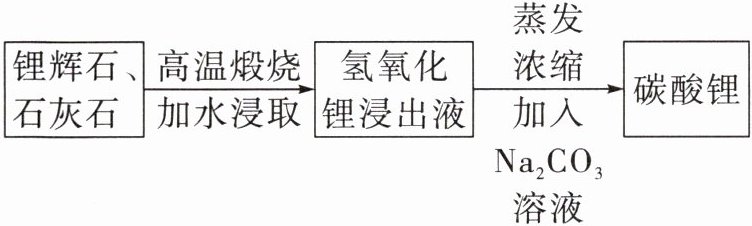
已知碳酸锂的溶解度与温度的关系如下表:

(1)对溶液进行蒸发浓缩后分离出碳酸锂的实验操作是 (
(2)碳酸锂的溶解度随温度升高而 (
(3)在分离碳酸锂固体时,为获得更多产品,应选择 (
(4)为减少碳酸锂因溶解而损失,应选择 (

已知碳酸锂的溶解度与温度的关系如下表:

(1)对溶液进行蒸发浓缩后分离出碳酸锂的实验操作是 (
过滤
)。(2)碳酸锂的溶解度随温度升高而 (
减小
)。(3)在分离碳酸锂固体时,为获得更多产品,应选择 (
较高温度
),理由是 碳酸锂溶解度随温度升高而减小,高温时碳酸锂在溶液中溶解量少,能获得更多固体
。(4)为减少碳酸锂因溶解而损失,应选择 (
热水
)洗涤。
答案:
(1)过滤
(2)减小
(3)较高温度 碳酸锂溶解度随温度升高而减小,高温时碳酸锂在溶液中溶解量少,能获得更多固体
(4)热水
(1)过滤
(2)减小
(3)较高温度 碳酸锂溶解度随温度升高而减小,高温时碳酸锂在溶液中溶解量少,能获得更多固体
(4)热水
查看更多完整答案,请扫码查看


