第100页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
如图为$KNO_3、$NaCl、$Ca(OH)_2$的溶解度曲线,回答下列问题。

考查点1 溶解度的理解$^2⁰⁰$考
(1)图1中P点的含义是
(2)20℃时,NaCl和$KNO_3$的溶解度大小关系为
(3)NaCl和$KNO_3$的溶解度均随温度的升高而

考查点1 溶解度的理解$^2⁰⁰$考
(1)图1中P点的含义是
$t^{\circ}C$时,$KNO_{3}$和$NaCl$的溶解度相等
。(2)20℃时,NaCl和$KNO_3$的溶解度大小关系为
$NaCl>KNO_{3}$
。(3)NaCl和$KNO_3$的溶解度均随温度的升高而
增大
,其中受温度影响变化较大的是$KNO_{3}$
;$Ca(OH)_2$的溶解度随温度的升高而减小
。
答案:
1. (1)
$t^{\circ}C$时,$KNO_{3}$和$NaCl$的溶解度相等。
2. (2)
$NaCl>KNO_{3}$。
3. (3)
增大;$KNO_{3}$;减小。
$t^{\circ}C$时,$KNO_{3}$和$NaCl$的溶解度相等。
2. (2)
$NaCl>KNO_{3}$。
3. (3)
增大;$KNO_{3}$;减小。
考查点2 饱和溶液与不饱和溶液的判断及转化^1⁰^1考
(4)将50℃时KNO_3的饱和溶液降温至t℃,所得溶液是 (填“饱和”或“不饱和”)溶液。
(5)将t℃时接近饱和的NaCl溶液变为饱和溶液采用的方法是 ;将30℃时Ca(OH)_2的不饱和溶液变为该温度下的饱和溶液的方法是 。
(4)将50℃时KNO_3的饱和溶液降温至t℃,所得溶液是 (填“饱和”或“不饱和”)溶液。
(5)将t℃时接近饱和的NaCl溶液变为饱和溶液采用的方法是 ;将30℃时Ca(OH)_2的不饱和溶液变为该温度下的饱和溶液的方法是 。
答案:
(4)饱和
(5)增加溶质(或蒸发溶剂等合理方法);增加溶质(或蒸发溶剂等合理方法)
【方法总结】根据数据判断饱和溶液与不饱和溶液

(4)饱和
(5)增加溶质(或蒸发溶剂等合理方法);增加溶质(或蒸发溶剂等合理方法)
【方法总结】根据数据判断饱和溶液与不饱和溶液

考查点3 根据溶解度曲线判断物质的提纯方法^8^9考
(6)若KNO_3中混有少量NaCl,提纯KNO_3的方法为 。
(7)若NaCl中混有少量KNO_3,提纯NaCl的方法为 。
(6)若KNO_3中混有少量NaCl,提纯KNO_3的方法为 。
(7)若NaCl中混有少量KNO_3,提纯NaCl的方法为 。
答案:
(6) 解:因为硝酸钾的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,所以若$KNO_3$中混有少量$NaCl$,提纯$KNO_3$的方法为降温结晶(或冷却热饱和溶液)。
(7) 解:因为氯化钠的溶解度受温度影响较小,硝酸钾的溶解度受温度影响较大,所以若$NaCl$中混有少量$KNO_3$,提纯$NaCl$的方法为蒸发结晶。
(6) 解:因为硝酸钾的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,所以若$KNO_3$中混有少量$NaCl$,提纯$KNO_3$的方法为降温结晶(或冷却热饱和溶液)。
(7) 解:因为氯化钠的溶解度受温度影响较小,硝酸钾的溶解度受温度影响较大,所以若$NaCl$中混有少量$KNO_3$,提纯$NaCl$的方法为蒸发结晶。
考查点4 一定温度下溶液相关量的计算和比较^2^5^9考
(8)50℃时,将100gKNO_3固体加入100g水中,充分溶解后所得溶液的质量为 g,溶质质量分数为 (计算结果保留一位小数)。
(9)20℃时,NaCl和KNO_3的饱和溶液中溶质质量分数的大小关系为 。
(8)50℃时,将100gKNO_3固体加入100g水中,充分溶解后所得溶液的质量为 g,溶质质量分数为 (计算结果保留一位小数)。
(9)20℃时,NaCl和KNO_3的饱和溶液中溶质质量分数的大小关系为 。
答案:
1. (8)
解:
查溶解度曲线可知,$50^{\circ}C$时$KNO_3$的溶解度是$85.5g$。
这意味着在$50^{\circ}C$时,$100g$水中最多能溶解$85.5gKNO_3$。
那么将$100gKNO_3$固体加入$100g$水中,充分溶解后,溶解的$KNO_3$质量为$85.5g$。
所得溶液质量$m = m_{溶质}+m_{溶剂}=85.5g + 100g=185.5g$。
溶质质量分数$\omega=\frac{m_{溶质}}{m_{溶液}}×100\%=\frac{85.5g}{185.5g}×100\%\approx46.1\%$。
2. (9)
答案:$NaCl\gt KNO_3$。
解:
查溶解度曲线可知,$20^{\circ}C$时,$NaCl$的溶解度大于$KNO_3$的溶解度。
根据饱和溶液溶质质量分数公式$\omega=\frac{S}{100 + S}×100\%$($S$为溶解度),因为$S_{NaCl}\gt S_{KNO_3}(20^{\circ}C)$,所以$20^{\circ}C$时,$NaCl$和$KNO_3$的饱和溶液中溶质质量分数的大小关系为$NaCl\gt KNO_3$。
【方法总结】一定温度下,比较不同物质溶质质量分数大小的方法
(1)不饱和溶液:×100%,代入公式计算后比较
(2)饱和溶液:×100%,S越大,溶质质量分数越大
解:
查溶解度曲线可知,$50^{\circ}C$时$KNO_3$的溶解度是$85.5g$。
这意味着在$50^{\circ}C$时,$100g$水中最多能溶解$85.5gKNO_3$。
那么将$100gKNO_3$固体加入$100g$水中,充分溶解后,溶解的$KNO_3$质量为$85.5g$。
所得溶液质量$m = m_{溶质}+m_{溶剂}=85.5g + 100g=185.5g$。
溶质质量分数$\omega=\frac{m_{溶质}}{m_{溶液}}×100\%=\frac{85.5g}{185.5g}×100\%\approx46.1\%$。
2. (9)
答案:$NaCl\gt KNO_3$。
解:
查溶解度曲线可知,$20^{\circ}C$时,$NaCl$的溶解度大于$KNO_3$的溶解度。
根据饱和溶液溶质质量分数公式$\omega=\frac{S}{100 + S}×100\%$($S$为溶解度),因为$S_{NaCl}\gt S_{KNO_3}(20^{\circ}C)$,所以$20^{\circ}C$时,$NaCl$和$KNO_3$的饱和溶液中溶质质量分数的大小关系为$NaCl\gt KNO_3$。
【方法总结】一定温度下,比较不同物质溶质质量分数大小的方法
(1)不饱和溶液:×100%,代入公式计算后比较
(2)饱和溶液:×100%,S越大,溶质质量分数越大
考查点5 改变温度时溶液中各种量的变化^1⁰^7考
(10)50℃时,将等质量的NaCl、KNO_3的饱和溶液分别降温到20℃,所得溶液中溶质质量的大小关系为 ,溶液质量的大小关系为 ,溶质质量分数的大小关系为 ,析出晶体质量的大小关系为 。
(11)20℃时,将NaCl、KNO_3和Ca(OH)_2的饱和溶液升温至50℃,有固体析出的是 ,所得溶液的溶质质量分数的大小关系为 。
(10)50℃时,将等质量的NaCl、KNO_3的饱和溶液分别降温到20℃,所得溶液中溶质质量的大小关系为 ,溶液质量的大小关系为 ,溶质质量分数的大小关系为 ,析出晶体质量的大小关系为 。
(11)20℃时,将NaCl、KNO_3和Ca(OH)_2的饱和溶液升温至50℃,有固体析出的是 ,所得溶液的溶质质量分数的大小关系为 。
答案:
【方法总结】温度改变时饱和溶液中相关量的变化
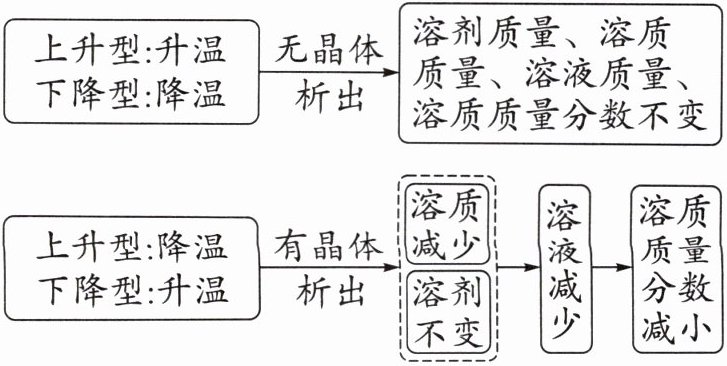
1. (10)
解:
对于$NaCl$和$KNO_3$,$KNO_3$的溶解度受温度影响大,$NaCl$溶解度受温度影响小。
设$50^{\circ}C$时$NaCl$、$KNO_3$饱和溶液质量都为$m$,$50^{\circ}C$时$S_{KNO_3}\gt S_{NaCl}$,根据$饱和溶液中溶质质量分数=\frac{S}{100 + S}×100\%$,则$50^{\circ}C$时$KNO_3$饱和溶液中溶质质量$m_{KNO_3}=\frac{S_{KNO_3}}{100 + S_{KNO_3}}× m$,$NaCl$饱和溶液中溶质质量$m_{NaCl}=\frac{S_{NaCl}}{100+S_{NaCl}}× m$,所以$m_{KNO_3}\gt m_{NaCl}$。
降温到$20^{\circ}C$,$KNO_3$析出晶体多,$NaCl$析出晶体少。
溶质质量:$NaCl\gt KNO_3$(因为$KNO_3$析出晶体多)。
溶液质量:$NaCl\gt KNO_3$($KNO_3$析出晶体多,溶液质量减少多)。
$20^{\circ}C$时$S_{NaCl}\gt S_{KNO_3}$,根据$饱和溶液中溶质质量分数=\frac{S}{100 + S}×100\%$,溶质质量分数:$NaCl\gt KNO_3$。
析出晶体质量:$KNO_3\gt NaCl$。
2. (11)
$Ca(OH)_2$的溶解度随温度升高而减小,$NaCl$、$KNO_3$溶解度随温度升高而增大。
有固体析出的是$Ca(OH)_2$饱和溶液。
$20^{\circ}C$时$S_{NaCl}\gt S_{KNO_3}\gt S_{Ca(OH)_2}$,$NaCl$、$KNO_3$升温变为不饱和溶液,溶质质量分数不变,$Ca(OH)_2$升温析出晶体,溶质质量分数减小。
溶质质量分数:$NaCl\gt KNO_3\gt Ca(OH)_2$。
综上,(10)溶质质量:$NaCl\gt KNO_3$;溶液质量:$NaCl\gt KNO_3$;溶质质量分数:$NaCl\gt KNO_3$;析出晶体质量:$KNO_3\gt NaCl$。(11)有固体析出的是$Ca(OH)_2$;溶质质量分数:$NaCl\gt KNO_3\gt Ca(OH)_2$。
【方法总结】温度改变时饱和溶液中相关量的变化

1. (10)
解:
对于$NaCl$和$KNO_3$,$KNO_3$的溶解度受温度影响大,$NaCl$溶解度受温度影响小。
设$50^{\circ}C$时$NaCl$、$KNO_3$饱和溶液质量都为$m$,$50^{\circ}C$时$S_{KNO_3}\gt S_{NaCl}$,根据$饱和溶液中溶质质量分数=\frac{S}{100 + S}×100\%$,则$50^{\circ}C$时$KNO_3$饱和溶液中溶质质量$m_{KNO_3}=\frac{S_{KNO_3}}{100 + S_{KNO_3}}× m$,$NaCl$饱和溶液中溶质质量$m_{NaCl}=\frac{S_{NaCl}}{100+S_{NaCl}}× m$,所以$m_{KNO_3}\gt m_{NaCl}$。
降温到$20^{\circ}C$,$KNO_3$析出晶体多,$NaCl$析出晶体少。
溶质质量:$NaCl\gt KNO_3$(因为$KNO_3$析出晶体多)。
溶液质量:$NaCl\gt KNO_3$($KNO_3$析出晶体多,溶液质量减少多)。
$20^{\circ}C$时$S_{NaCl}\gt S_{KNO_3}$,根据$饱和溶液中溶质质量分数=\frac{S}{100 + S}×100\%$,溶质质量分数:$NaCl\gt KNO_3$。
析出晶体质量:$KNO_3\gt NaCl$。
2. (11)
$Ca(OH)_2$的溶解度随温度升高而减小,$NaCl$、$KNO_3$溶解度随温度升高而增大。
有固体析出的是$Ca(OH)_2$饱和溶液。
$20^{\circ}C$时$S_{NaCl}\gt S_{KNO_3}\gt S_{Ca(OH)_2}$,$NaCl$、$KNO_3$升温变为不饱和溶液,溶质质量分数不变,$Ca(OH)_2$升温析出晶体,溶质质量分数减小。
溶质质量分数:$NaCl\gt KNO_3\gt Ca(OH)_2$。
综上,(10)溶质质量:$NaCl\gt KNO_3$;溶液质量:$NaCl\gt KNO_3$;溶质质量分数:$NaCl\gt KNO_3$;析出晶体质量:$KNO_3\gt NaCl$。(11)有固体析出的是$Ca(OH)_2$;溶质质量分数:$NaCl\gt KNO_3\gt Ca(OH)_2$。
查看更多完整答案,请扫码查看


