2026年高考领航卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高考领航卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
16. (15分)Ni₂O₃广泛应用于蓄电池、颜料等领域。以镍锌合金废料(主要含Ni、Zn、Mg、Fe、Cu等金属)为原料制取Ni₂O₃的工艺流程如图。
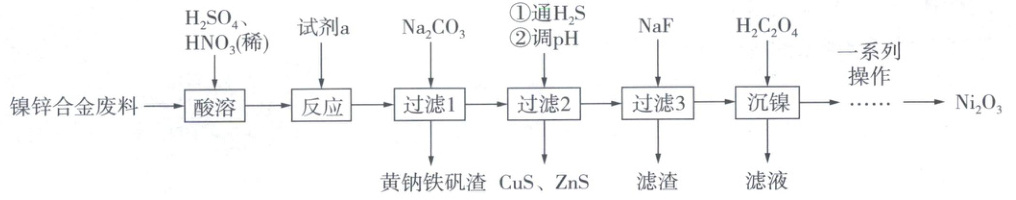
回答下列问题:
(1)基态Mg原子的价电子排布图为______。
(2)写出“酸溶”时Cu发生反应的离子方程式______。
(3)加入试剂a的目的是将溶液中的Fe²⁺转化为Fe³⁺,选用的最佳试剂a为______(填标号)。
A. Cl₂
B. HNO₃
C. KMnO₄
D. H₂O₂
(4)“过滤1”步骤中,加入Na₂CO₃将溶液的pH调至1.6 ~ 1.8,得到黄钠铁矾[NaFe₃(SO₄)₂(OH)₆],该反应的离子方程式为______。
(5)向“过滤1”的滤液中通入H₂S至饱和除Cu、Zn元素,且控制溶液的pH = 1,则此时溶液中c(Cu²⁺) = ______mol·L⁻¹[已知:溶液中c(H₂S) = 0.1 mol·L⁻¹;H₂S的Kₐ₁ = 1×10⁻⁷、Kₐ₂ = 1×10⁻¹³;CuS的Kₛₚ = 1×10⁻³⁶]。
(6)滤渣的成分为______(填化学式)。“沉镍”得到的滤液所含阳离子主要有______(填离子符号)。
(7)一系列操作包括洗涤NiC₂O₄沉淀和NiC₂O₄在空气中煅烧生成Ni₂O₃,实验室洗涤NiC₂O₄沉淀的具体操作为______,NiC₂O₄在空气中煅烧生成83 g Ni₂O₃转移______mol电子。

回答下列问题:
(1)基态Mg原子的价电子排布图为______。
(2)写出“酸溶”时Cu发生反应的离子方程式______。
(3)加入试剂a的目的是将溶液中的Fe²⁺转化为Fe³⁺,选用的最佳试剂a为______(填标号)。
A. Cl₂
B. HNO₃
C. KMnO₄
D. H₂O₂
(4)“过滤1”步骤中,加入Na₂CO₃将溶液的pH调至1.6 ~ 1.8,得到黄钠铁矾[NaFe₃(SO₄)₂(OH)₆],该反应的离子方程式为______。
(5)向“过滤1”的滤液中通入H₂S至饱和除Cu、Zn元素,且控制溶液的pH = 1,则此时溶液中c(Cu²⁺) = ______mol·L⁻¹[已知:溶液中c(H₂S) = 0.1 mol·L⁻¹;H₂S的Kₐ₁ = 1×10⁻⁷、Kₐ₂ = 1×10⁻¹³;CuS的Kₛₚ = 1×10⁻³⁶]。
(6)滤渣的成分为______(填化学式)。“沉镍”得到的滤液所含阳离子主要有______(填离子符号)。
(7)一系列操作包括洗涤NiC₂O₄沉淀和NiC₂O₄在空气中煅烧生成Ni₂O₃,实验室洗涤NiC₂O₄沉淀的具体操作为______,NiC₂O₄在空气中煅烧生成83 g Ni₂O₃转移______mol电子。
答案:
(1) (1分)
(1分)
(2)3Cu+8H⁺+2NO₃⁻==3Cu²⁺+2NO↑+4H₂O(2分)
(3)D(1分)
(4)Na⁺+3Fe³⁺+2SO₄²⁻+3H₂O+3CO₃²⁻==NaFe₃(SO₄)₂(OH)₆↓+3CO₂↑(2分)
(5)1×10⁻¹⁷(2分)
(6)MgF₂(1分) Na⁺、H⁺(2分)
(7)沿玻璃棒向漏斗中加蒸馏水至刚好浸没沉淀,待水自然流下后,重复操作2~3次(2分) 3(2分)
[评分标准]
(1)写成价电子排布式不得分
(2)化学式正确但未配平扣1分
(3)写成化学式或小写字母d不得分
(4)化学式正确但未配平或写成化学方程式扣1分
(5)写“10⁻¹⁷”也得分
(6)第一空写化学名称不得分;第二空写对1个得1分,写错不得分
(7)第一空不写“重复操作2~3次”扣1分
流程梳理
制取Ni₂O₃的工艺流程分析
(1)基态Mg原子的价电子排布式为3s²,故基态Mg原子的价电子排布图为
(2)“酸溶”时Cu与稀硝酸反应,离子方程式为3Cu+8H⁺+2NO₃⁻==3Cu²⁺+2NO↑+4H₂O。
(3)加入试剂a的目的是将溶液中的Fe²⁺转化为Fe³⁺,Cl₂为有毒气体,不是最佳试剂;硝酸与Fe²⁺反应生成的NO为有毒气体,不是最佳试剂;KMnO₄与Fe²⁺反应引入杂质离子,不是最佳试剂;H₂O₂与Fe²⁺反应生成Fe³⁺和H₂O,为最佳试剂。
(4)“过滤1”步骤中,溶液呈酸性,溶液中的Fe³⁺、SO₄²⁻与加入的Na⁺、CO₃²⁻反应生成NaFe₃(SO₄)₂(OH)₆沉淀和CO₂气体,反应的离子方程式为Na⁺+3Fe³⁺+2SO₄²⁻+3H₂O+3CO₃²⁻==NaFe₃(SO₄)₂(OH)₆↓+3CO₂↑。
(5)Kₐ₁=$\frac{c(H⁺)c(HS⁻)}{c(H₂S)}$,Kₐ₂=$\frac{c(H⁺)c(S²⁻)}{c(HS⁻)}$,Kₐ₁Kₐ₂=$\frac{c²(H⁺)c(S²⁻)}{c²(H₂S)}$,c(S²⁻)=$\frac{Kₐ₁Kₐ₂c(H₂S)}{c²(H⁺)}$=$\frac{1×10⁻⁷×1×10⁻¹³×0.1}{10⁻²}$mol·L⁻¹=1×10⁻¹⁹mol·L⁻¹,Kₛₚ(CuS)=c(Cu²⁺)c(S²⁻)=c(Cu²⁺)×1×10⁻¹⁹=1×10⁻³⁶,c(Cu²⁺)=1×10⁻¹⁷mol·L⁻¹。
(6)镍锌合金废料主要含Ni、Zn、Mg、Fe、Cu等金属,前面步骤除去了Fe、Zn、Cu,则加入NaF的目的是除去Mg²⁺,滤渣为MgF₂。“沉镍”得到的滤液中所含阳离子主要有Na⁺、H⁺。
(7)NiC₂O₄在空气中煅烧的化学方程式为4NiC₂O₄+3O₂$\stackrel{煅烧}{=\!=\!=}$2Ni₂O₃+8CO₂,83gNi₂O₃的物质的量为0.5mol,由化学方程式可知,生成2molNi₂O₃转移12mol电子,则煅烧生成83gNi₂O₃转移电子3mol。
(1)
 (1分)
(1分)(2)3Cu+8H⁺+2NO₃⁻==3Cu²⁺+2NO↑+4H₂O(2分)
(3)D(1分)
(4)Na⁺+3Fe³⁺+2SO₄²⁻+3H₂O+3CO₃²⁻==NaFe₃(SO₄)₂(OH)₆↓+3CO₂↑(2分)
(5)1×10⁻¹⁷(2分)
(6)MgF₂(1分) Na⁺、H⁺(2分)
(7)沿玻璃棒向漏斗中加蒸馏水至刚好浸没沉淀,待水自然流下后,重复操作2~3次(2分) 3(2分)
[评分标准]
(1)写成价电子排布式不得分
(2)化学式正确但未配平扣1分
(3)写成化学式或小写字母d不得分
(4)化学式正确但未配平或写成化学方程式扣1分
(5)写“10⁻¹⁷”也得分
(6)第一空写化学名称不得分;第二空写对1个得1分,写错不得分
(7)第一空不写“重复操作2~3次”扣1分
流程梳理
制取Ni₂O₃的工艺流程分析
(1)基态Mg原子的价电子排布式为3s²,故基态Mg原子的价电子排布图为

(2)“酸溶”时Cu与稀硝酸反应,离子方程式为3Cu+8H⁺+2NO₃⁻==3Cu²⁺+2NO↑+4H₂O。
(3)加入试剂a的目的是将溶液中的Fe²⁺转化为Fe³⁺,Cl₂为有毒气体,不是最佳试剂;硝酸与Fe²⁺反应生成的NO为有毒气体,不是最佳试剂;KMnO₄与Fe²⁺反应引入杂质离子,不是最佳试剂;H₂O₂与Fe²⁺反应生成Fe³⁺和H₂O,为最佳试剂。
(4)“过滤1”步骤中,溶液呈酸性,溶液中的Fe³⁺、SO₄²⁻与加入的Na⁺、CO₃²⁻反应生成NaFe₃(SO₄)₂(OH)₆沉淀和CO₂气体,反应的离子方程式为Na⁺+3Fe³⁺+2SO₄²⁻+3H₂O+3CO₃²⁻==NaFe₃(SO₄)₂(OH)₆↓+3CO₂↑。
(5)Kₐ₁=$\frac{c(H⁺)c(HS⁻)}{c(H₂S)}$,Kₐ₂=$\frac{c(H⁺)c(S²⁻)}{c(HS⁻)}$,Kₐ₁Kₐ₂=$\frac{c²(H⁺)c(S²⁻)}{c²(H₂S)}$,c(S²⁻)=$\frac{Kₐ₁Kₐ₂c(H₂S)}{c²(H⁺)}$=$\frac{1×10⁻⁷×1×10⁻¹³×0.1}{10⁻²}$mol·L⁻¹=1×10⁻¹⁹mol·L⁻¹,Kₛₚ(CuS)=c(Cu²⁺)c(S²⁻)=c(Cu²⁺)×1×10⁻¹⁹=1×10⁻³⁶,c(Cu²⁺)=1×10⁻¹⁷mol·L⁻¹。
(6)镍锌合金废料主要含Ni、Zn、Mg、Fe、Cu等金属,前面步骤除去了Fe、Zn、Cu,则加入NaF的目的是除去Mg²⁺,滤渣为MgF₂。“沉镍”得到的滤液中所含阳离子主要有Na⁺、H⁺。
(7)NiC₂O₄在空气中煅烧的化学方程式为4NiC₂O₄+3O₂$\stackrel{煅烧}{=\!=\!=}$2Ni₂O₃+8CO₂,83gNi₂O₃的物质的量为0.5mol,由化学方程式可知,生成2molNi₂O₃转移12mol电子,则煅烧生成83gNi₂O₃转移电子3mol。
17. (14分)ALC(3 - 氯丙烯,结构简式为CH₂=CHCH₂Cl)是制取环氧氯丙烷、农药等的主要原料。丙烯高温氯化制ALC的反应如下:
反应Ⅰ. CH₂=CHCH₃(g) + Cl₂(g) ⇌ CH₂=CHCH₂Cl(g) + HCl(g) ΔH₁ = - 100 kJ·mol⁻¹
反应Ⅱ. CH₂=CHCH₃(g) + Cl₂(g) ⇌ CH₂ClCHClCH₃(g) ΔH₂ = - 133 kJ·mol⁻¹
回答下列问题:
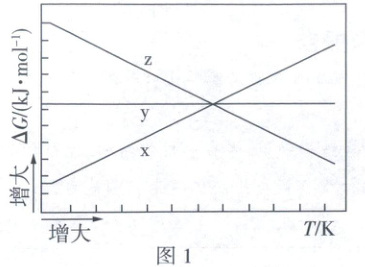
(1)反应Ⅲ. CH₂=CHCH₂Cl(g) + HCl(g) ⇌ CH₂ClCHClCH₃(g) ΔH₃ = ______kJ·mol⁻¹,此反应能够自发进行的条件是______(填“高温”“低温”或“任意温度”)。已知ΔG = ΔH - TΔS,ΔG随着温度变化的三种趋势如图1所示。能用来表示反应Ⅱ的线是______(填“x”“y”或“z”)。
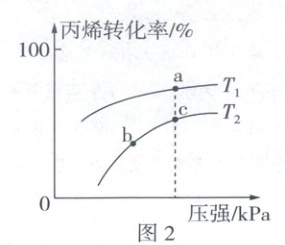
(2)将丙烯和氯气按相同比例,置于有相同催化剂的密闭容器中,在T₁、T₂(T₁ > T₂)下,相同时间内,丙烯的转化率随压强的变化关系如图2所示。
①T₂温度下,丙烯的转化率随压强的变化呈现如图变化趋势的原因是______。
②a、b、c三点的相应条件下,反应Ⅱ的平衡常数Kₐ、Kᵦ、Kₑ大小关系为______。
③提高CH₂=CHCH₂Cl选择性的措施为______(写出一条即可)。
(3)一定温度下,向填充有催化剂的恒容密闭容器中以物质的量之比为1:1充入CH₂=CHCH₃和Cl₂发生反应Ⅰ和Ⅱ。实验测得反应前容器内气体压强为200 kPa,t min后达到平衡,容器内气体压强为180 kPa,ALC的分压为60 kPa。0 ~ t min,用CH₂=CHCH₃表示的平均反应速率为______kPa·min⁻¹,反应Ⅰ的平衡常数Kₚ = ______(用平衡时各组分的分压代替浓度计算)。
反应Ⅰ. CH₂=CHCH₃(g) + Cl₂(g) ⇌ CH₂=CHCH₂Cl(g) + HCl(g) ΔH₁ = - 100 kJ·mol⁻¹
反应Ⅱ. CH₂=CHCH₃(g) + Cl₂(g) ⇌ CH₂ClCHClCH₃(g) ΔH₂ = - 133 kJ·mol⁻¹
回答下列问题:
(1)反应Ⅲ. CH₂=CHCH₂Cl(g) + HCl(g) ⇌ CH₂ClCHClCH₃(g) ΔH₃ = ______kJ·mol⁻¹,此反应能够自发进行的条件是______(填“高温”“低温”或“任意温度”)。已知ΔG = ΔH - TΔS,ΔG随着温度变化的三种趋势如图1所示。能用来表示反应Ⅱ的线是______(填“x”“y”或“z”)。
(2)将丙烯和氯气按相同比例,置于有相同催化剂的密闭容器中,在T₁、T₂(T₁ > T₂)下,相同时间内,丙烯的转化率随压强的变化关系如图2所示。
①T₂温度下,丙烯的转化率随压强的变化呈现如图变化趋势的原因是______。
②a、b、c三点的相应条件下,反应Ⅱ的平衡常数Kₐ、Kᵦ、Kₑ大小关系为______。
③提高CH₂=CHCH₂Cl选择性的措施为______(写出一条即可)。
(3)一定温度下,向填充有催化剂的恒容密闭容器中以物质的量之比为1:1充入CH₂=CHCH₃和Cl₂发生反应Ⅰ和Ⅱ。实验测得反应前容器内气体压强为200 kPa,t min后达到平衡,容器内气体压强为180 kPa,ALC的分压为60 kPa。0 ~ t min,用CH₂=CHCH₃表示的平均反应速率为______kPa·min⁻¹,反应Ⅰ的平衡常数Kₚ = ______(用平衡时各组分的分压代替浓度计算)。


答案:
(1)-33(2分) 低温(1分) x(1分)
(2)①反应未达到平衡,随着压强增大,反应速率加快,相同时间内,丙烯转化率增大(2分)
②Kₐ<Kᵦ=Kₙ(2分)
③及时移出HCl气体(2分)
(3)$\frac{80}{t}$(2分) 9(2分)
[评分标准]
(1)第一空不写“-”不得分
(2)①答出“反应未达到平衡”得1分;答出“压强增大,反应速率加快”得1分
②答“Kₐ<Kᵦ=Kₙ”也得分
③其他合理答案也得分,如“选用高效催化剂”等
(3)第二空写“$\frac{60×60}{20×20}$”也得分
化学反应原理
(1)根据盖斯定律,由反应Ⅱ - 反应Ⅰ得CH₂=CHCH₂Cl(g)+HCl(g)⇌CH₂ClCHClCH₃(g) ΔH₃=ΔH₂ - ΔH₁=-133kJ·mol⁻¹-(-100kJ·mol⁻¹)=-33kJ·mol⁻¹。此反应的ΔH₃<0,ΔS<0,因此低温条件下反应自发进行。反应Ⅱ为气体分子数减小的放热反应,即ΔS<0、ΔH<0,已知ΔG=ΔH - TΔS,随温度升高ΔG逐渐增大,故能用来表示反应Ⅱ的线是x。
(2)①根据图2判断T₂温度下,反应未达到平衡,因此,随着压强增大,反应速率加快,相同时间内,丙烯转化率增大。②反应Ⅱ为放热反应,因此温度升高平衡逆向移动,平衡常数减小,且温度相同时平衡常数不变,因此Kₐ<Kᵦ=Kₙ。
(3)当反应容器体积和温度不变时,气体压强与物质的量成正比,列式如下:
CH₂=CHCH₃(g)+Cl₂(g)⇌CH₂ClCHClCH₃(g)+HCl(g)
初始分压/kPa 100 100 0 0
变化分压/kPa 60 60 60 60
平衡分压/kPa 20 20 60 60
CH₂=CHCH₃(g)+Cl₂(g)⇌CH₂ClCHClCH₃(g)
变化分压/kPa 200 - 180 20 20
用CH₂=CHCH₃表示的平均反应速率为$\frac{60 + 20}{t}$kPa·min⁻¹=$\frac{80}{t}$kPa·min⁻¹,反应Ⅰ的平衡常数K=$\frac{60×60}{20×20}$=9。
(1)-33(2分) 低温(1分) x(1分)
(2)①反应未达到平衡,随着压强增大,反应速率加快,相同时间内,丙烯转化率增大(2分)
②Kₐ<Kᵦ=Kₙ(2分)
③及时移出HCl气体(2分)
(3)$\frac{80}{t}$(2分) 9(2分)
[评分标准]
(1)第一空不写“-”不得分
(2)①答出“反应未达到平衡”得1分;答出“压强增大,反应速率加快”得1分
②答“Kₐ<Kᵦ=Kₙ”也得分
③其他合理答案也得分,如“选用高效催化剂”等
(3)第二空写“$\frac{60×60}{20×20}$”也得分
化学反应原理
(1)根据盖斯定律,由反应Ⅱ - 反应Ⅰ得CH₂=CHCH₂Cl(g)+HCl(g)⇌CH₂ClCHClCH₃(g) ΔH₃=ΔH₂ - ΔH₁=-133kJ·mol⁻¹-(-100kJ·mol⁻¹)=-33kJ·mol⁻¹。此反应的ΔH₃<0,ΔS<0,因此低温条件下反应自发进行。反应Ⅱ为气体分子数减小的放热反应,即ΔS<0、ΔH<0,已知ΔG=ΔH - TΔS,随温度升高ΔG逐渐增大,故能用来表示反应Ⅱ的线是x。
(2)①根据图2判断T₂温度下,反应未达到平衡,因此,随着压强增大,反应速率加快,相同时间内,丙烯转化率增大。②反应Ⅱ为放热反应,因此温度升高平衡逆向移动,平衡常数减小,且温度相同时平衡常数不变,因此Kₐ<Kᵦ=Kₙ。
(3)当反应容器体积和温度不变时,气体压强与物质的量成正比,列式如下:
CH₂=CHCH₃(g)+Cl₂(g)⇌CH₂ClCHClCH₃(g)+HCl(g)
初始分压/kPa 100 100 0 0
变化分压/kPa 60 60 60 60
平衡分压/kPa 20 20 60 60
CH₂=CHCH₃(g)+Cl₂(g)⇌CH₂ClCHClCH₃(g)
变化分压/kPa 200 - 180 20 20
用CH₂=CHCH₃表示的平均反应速率为$\frac{60 + 20}{t}$kPa·min⁻¹=$\frac{80}{t}$kPa·min⁻¹,反应Ⅰ的平衡常数K=$\frac{60×60}{20×20}$=9。
查看更多完整答案,请扫码查看


