2026年高考领航卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高考领航卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
14. 有机酸H₃C₆H₅O₇(记作H₃B)为三元弱酸。常温下,H₃B、H₂B⁻、HB²⁻和B³⁻的分布分数δ[如δ(H₂B⁻) = c(H₂B⁻) / (c(H₃B) + c(H₂B⁻) + c(HB²⁻) + c(B³⁻))]随pH的变化如图所示。下列说法错误的是

A.曲线Ⅲ表示δ(HB²⁻)随pH的变化
B.w点对应溶液的pH约为3.95
C.z点溶液中:c(H⁺) = c(H₂B⁻) + 2c(HB²⁻) + 3c(B³⁻) + c(OH⁻)
D.常温下,0.1 mol·L⁻¹ Na₂HB溶液中,c(H⁺) > c(OH⁻)

A.曲线Ⅲ表示δ(HB²⁻)随pH的变化
B.w点对应溶液的pH约为3.95
C.z点溶液中:c(H⁺) = c(H₂B⁻) + 2c(HB²⁻) + 3c(B³⁻) + c(OH⁻)
D.常温下,0.1 mol·L⁻¹ Na₂HB溶液中,c(H⁺) > c(OH⁻)
答案:
14.C 弱电解质的电离平衡 H₂B为三元弱酸,则H₂B在溶液中发生分步电离:H₂B⇌H₂B⁻+H⁺,H₂B⁻⇌HB²⁻+H⁺,HB²⁻⇌B³⁻+H⁺,则曲线Ⅰ、Ⅱ、Ⅲ、Ⅳ分别为H₂B、H₂B⁻、HB²⁻、B³⁻的分布分数随pH的变化曲线,A正确;Kₐ₁=$\frac{c(H₂B⁻)c(H⁺)}{c(H₂B)}$,x点c(H₂B⁻)=c(H₂B),Kₐ₁=c(H⁺)=10⁻³.¹³,Kₐ₂=$\frac{c(HB²⁻)c(H⁺)}{c(H₂B⁻)}$,y点c(HB²⁻)=c(H₂B⁻),Kₐ₂=c(H⁺)=10⁻⁴.⁷⁶,Kₐ₁·Kₐ₂=10⁻³.¹³×10⁻⁴.⁷⁶=10⁻⁷.⁸⁹,w点c(H₂B⁻)=c(HB²⁻),则c²(H⁺)=10⁻⁷.⁹,w点pH=3.945≈3.95,B正确;z点溶液中,还存在加入的碱的阳离子,根据电荷守恒可知,c(H⁺)<c(H₂B⁻)+2c(HB²⁻)+3c(B³⁻)+c(OH⁻),C错误;z点c(HB²⁻)=c(B³⁻),则Kₐ₃=$\frac{c(B³⁻)c(H⁺)}{c(HB²⁻)}$=c(H⁺)=10⁻⁶.⁴⁰,Kₕ(B²⁻)=$\frac{c(HB²⁻)c(OH⁻)}{c(HB²⁻)}$=$\frac{c(HB²⁻)c(OH⁻)c(H⁺)}{c(HB²⁻)c(H⁺)}$=$\frac{K_w}{Kₐ₂}$=$\frac{10⁻¹⁴}{10⁻⁴.⁷⁶}$=10⁻⁹.²⁴<Kₐ₂,HB²⁻的电离程度大于其水解程度,c(H⁺)>c(OH⁻),D正确。
15. (14分)五氨氯化钴一般指二氯化一氯五氨合钴,化学式为[Co(NH₃)₅Cl]Cl₂。某实验小组同学制备[Co(NH₃)₅Cl]Cl₂并测定其中的氨含量的实验步骤及装置(夹持装置略)如下:
Ⅰ. [Co(NH₃)₅Cl]Cl₂的制备
制备[Co(NH₃)₅Cl]Cl₂的操作过程如图,其原理为CoCl₂在氨水中被H₂O₂氧化成[Co(NH₃)₅(H₂O)]Cl₃(深红色晶体),[Co(NH₃)₅(H₂O)]Cl₃不稳定,在115℃时加热脱水转化成稳定的紫红色的[Co(NH₃)₅Cl]Cl₂。
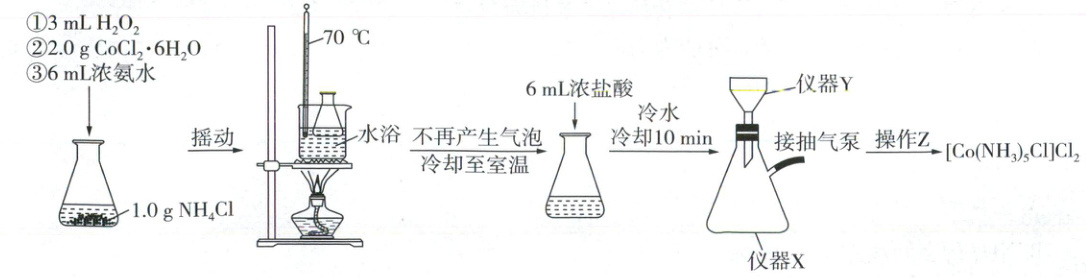
(1)仪器Y的名称为______。抽滤完毕,仪器X内的液体从______倒出。
(2)写出操作过程中生成[Co(NH₃)₅(H₂O)]Cl₃的化学方程式______。
(3)缓慢加入6 mL浓盐酸的作用是______。
(4)操作Z为:乙醇洗涤数次,6 mol·L⁻¹盐酸洗涤,______。
Ⅱ. 测定[Co(NH₃)₅Cl]Cl₂中的氨含量
准确称取0.2 g样品,加入20 mL水溶解,然后加入20 mL 30% NaOH溶液,充分加热,使产生的氨气全部蒸出到盛有足量硼酸溶液的氨接收瓶中,并用0.500 0 mol·L⁻¹的标准盐酸滴定接收瓶中的氨,记下消耗盐酸的体积为7.90 mL。
(5)0.500 0 mol·L⁻¹的标准盐酸盛放在______(填“酸式”或“碱式”)滴定管中,滴定前需排出装盐酸标准溶液的滴定管尖嘴处的气泡,其操作正确的图示为______(填字母)。

(6)[Co(NH₃)₅Cl]Cl₂中NH₃的质量分数为______%(保留三位有效数字),比理论值偏______(填“高”或“低”),造成此误差可能的原因是______。
Ⅰ. [Co(NH₃)₅Cl]Cl₂的制备
制备[Co(NH₃)₅Cl]Cl₂的操作过程如图,其原理为CoCl₂在氨水中被H₂O₂氧化成[Co(NH₃)₅(H₂O)]Cl₃(深红色晶体),[Co(NH₃)₅(H₂O)]Cl₃不稳定,在115℃时加热脱水转化成稳定的紫红色的[Co(NH₃)₅Cl]Cl₂。

(1)仪器Y的名称为______。抽滤完毕,仪器X内的液体从______倒出。
(2)写出操作过程中生成[Co(NH₃)₅(H₂O)]Cl₃的化学方程式______。
(3)缓慢加入6 mL浓盐酸的作用是______。
(4)操作Z为:乙醇洗涤数次,6 mol·L⁻¹盐酸洗涤,______。
Ⅱ. 测定[Co(NH₃)₅Cl]Cl₂中的氨含量
准确称取0.2 g样品,加入20 mL水溶解,然后加入20 mL 30% NaOH溶液,充分加热,使产生的氨气全部蒸出到盛有足量硼酸溶液的氨接收瓶中,并用0.500 0 mol·L⁻¹的标准盐酸滴定接收瓶中的氨,记下消耗盐酸的体积为7.90 mL。
(5)0.500 0 mol·L⁻¹的标准盐酸盛放在______(填“酸式”或“碱式”)滴定管中,滴定前需排出装盐酸标准溶液的滴定管尖嘴处的气泡,其操作正确的图示为______(填字母)。

(6)[Co(NH₃)₅Cl]Cl₂中NH₃的质量分数为______%(保留三位有效数字),比理论值偏______(填“高”或“低”),造成此误差可能的原因是______。
答案:
(1)布氏漏斗(1分) 上口(1分)
(2)2CoCl₂+2NH₄Cl+8NH₃+H₂O₂==2[Co(NH₃)₅(H₂O)]Cl₃ (2分)
(3)增大Cl⁻的浓度,使[Co(NH₃)₅(H₂O)]Cl₃⇌[Co(NH₃)₅(H₂O)]³⁺+3Cl⁻平衡逆向移动,利于[Co(NH₃)₅(H₂O)]Cl₃结晶析出(2分)
(4)在115℃下加热(2分)
(5)酸式(1分) D(1分)
(6)33.6(2分) 低(1分) 氨气未被接收瓶完全吸收(1分,答案合理即可)
[评分标准]
(1)第一空写“漏斗”不得分;第二空答“仪器X上口”或“吸滤瓶上口”也得分
(2)化学式正确但未配平扣1分
(3)答出“增大Cl⁻的浓度,使[Co(NH₃)₅(H₂O)]Cl₃⇌[Co(NH₃)₅(H₂O)]³⁺+3Cl⁻平衡逆向移动”得1分,答出“利于[Co(NH₃)₅(H₂O)]Cl₃结晶析出”得1分
(4)只答“加热”得1分
(5)第二空写成小写字母不得分
(6)第一空不是三位有效数字不得分;第三空答案合理即得分
[Co(NH₃)₅Cl]Cl₂的制备及其中氨含量的测定
(1)仪器Y的名称为布氏漏斗。抽滤完毕,吸滤瓶内的液体从吸滤瓶(仪器X)上口倒出。
(2)CoCl₂、NH₄Cl、NH₃和H₂O₂反应,Co(Ⅱ)被H₂O₂氧化成Co(Ⅲ),根据得失电子守恒和质量守恒得到反应的化学方程式为2CoCl₂+2NH₄Cl+8NH₃+H₂O₂==2[Co(NH₃)₅(H₂O)]Cl₃。
(3)[Co(NH₃)₅(H₂O)]Cl₃在溶液中存在平衡[Co(NH₃)₅(H₂O)]Cl₃⇌[Co(NH₃)₅(H₂O)]³⁺+3Cl⁻,加入浓盐酸,增加Cl⁻的浓度,使[Co(NH₃)₅(H₂O)]Cl₃⇌[Co(NH₃)₅(H₂O)]³⁺+3Cl⁻平衡逆向移动,利于[Co(NH₃)₅(H₂O)]Cl₃结晶析出。
(4)抽滤后得到[Co(NH₃)₅(H₂O)]Cl₃固体,先后经醇洗和盐酸洗涤,根据题干信息,[Co(NH₃)₅(H₂O)]Cl₃不稳定,在115℃时加热脱水转化成稳定的紫红色的[Co(NH₃)₅Cl]Cl₂,故洗涤后的固体在115℃下加热可得产品。
(5)盛装盐酸标准溶液用酸式滴定管,排酸式滴定管尖嘴处的气泡的操作应选D。
(6)产品中NH₃的质量分数为$\frac{0.5000mol·L⁻¹×7.90×10⁻³L×17g·mol⁻¹}{0.2g}$×100%≈33.6%。[Co(NH₃)₅Cl]Cl₂中NH₃的理论质量分数为$\frac{17×5}{250.5}$×100%≈33.9%,因此测得的值比理论值偏低。造成此误差的原因可能是氨气未被接收瓶完全吸收等。
(1)布氏漏斗(1分) 上口(1分)
(2)2CoCl₂+2NH₄Cl+8NH₃+H₂O₂==2[Co(NH₃)₅(H₂O)]Cl₃ (2分)
(3)增大Cl⁻的浓度,使[Co(NH₃)₅(H₂O)]Cl₃⇌[Co(NH₃)₅(H₂O)]³⁺+3Cl⁻平衡逆向移动,利于[Co(NH₃)₅(H₂O)]Cl₃结晶析出(2分)
(4)在115℃下加热(2分)
(5)酸式(1分) D(1分)
(6)33.6(2分) 低(1分) 氨气未被接收瓶完全吸收(1分,答案合理即可)
[评分标准]
(1)第一空写“漏斗”不得分;第二空答“仪器X上口”或“吸滤瓶上口”也得分
(2)化学式正确但未配平扣1分
(3)答出“增大Cl⁻的浓度,使[Co(NH₃)₅(H₂O)]Cl₃⇌[Co(NH₃)₅(H₂O)]³⁺+3Cl⁻平衡逆向移动”得1分,答出“利于[Co(NH₃)₅(H₂O)]Cl₃结晶析出”得1分
(4)只答“加热”得1分
(5)第二空写成小写字母不得分
(6)第一空不是三位有效数字不得分;第三空答案合理即得分
[Co(NH₃)₅Cl]Cl₂的制备及其中氨含量的测定
(1)仪器Y的名称为布氏漏斗。抽滤完毕,吸滤瓶内的液体从吸滤瓶(仪器X)上口倒出。
(2)CoCl₂、NH₄Cl、NH₃和H₂O₂反应,Co(Ⅱ)被H₂O₂氧化成Co(Ⅲ),根据得失电子守恒和质量守恒得到反应的化学方程式为2CoCl₂+2NH₄Cl+8NH₃+H₂O₂==2[Co(NH₃)₅(H₂O)]Cl₃。
(3)[Co(NH₃)₅(H₂O)]Cl₃在溶液中存在平衡[Co(NH₃)₅(H₂O)]Cl₃⇌[Co(NH₃)₅(H₂O)]³⁺+3Cl⁻,加入浓盐酸,增加Cl⁻的浓度,使[Co(NH₃)₅(H₂O)]Cl₃⇌[Co(NH₃)₅(H₂O)]³⁺+3Cl⁻平衡逆向移动,利于[Co(NH₃)₅(H₂O)]Cl₃结晶析出。
(4)抽滤后得到[Co(NH₃)₅(H₂O)]Cl₃固体,先后经醇洗和盐酸洗涤,根据题干信息,[Co(NH₃)₅(H₂O)]Cl₃不稳定,在115℃时加热脱水转化成稳定的紫红色的[Co(NH₃)₅Cl]Cl₂,故洗涤后的固体在115℃下加热可得产品。
(5)盛装盐酸标准溶液用酸式滴定管,排酸式滴定管尖嘴处的气泡的操作应选D。
(6)产品中NH₃的质量分数为$\frac{0.5000mol·L⁻¹×7.90×10⁻³L×17g·mol⁻¹}{0.2g}$×100%≈33.6%。[Co(NH₃)₅Cl]Cl₂中NH₃的理论质量分数为$\frac{17×5}{250.5}$×100%≈33.9%,因此测得的值比理论值偏低。造成此误差的原因可能是氨气未被接收瓶完全吸收等。
查看更多完整答案,请扫码查看


