2026年高考领航卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高考领航卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
17. (14分)硫代硫酸钠晶体(Na₂S₂O₃·5H₂O)是实验室中常用的一种试剂,也是一种重要的化工原料。某工厂实验室人员利用该工厂两种尾气制备硫代硫酸钠晶体,实验装置如图所示(夹持装置略)。
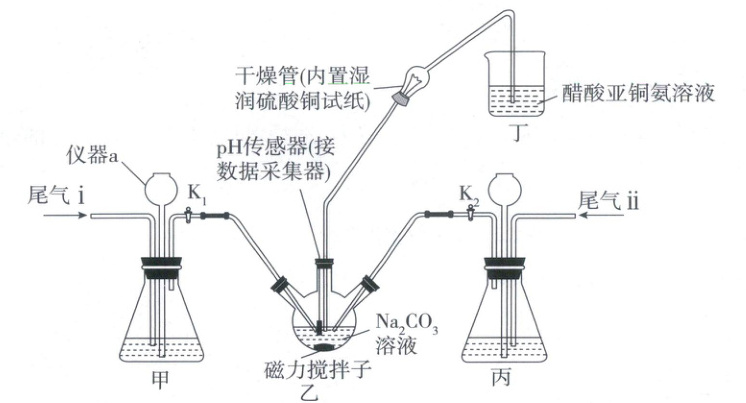
已知:①两种尾气成分如表所示。

②硫代硫酸钠易溶于水,难溶于乙醇,在中性或碱性溶液中能稳定存在。
回答下列问题:
(1)仪器a的名称是 ;在该实验中,仪器a的作用是 。
(2)实验时,先通入过量尾气i,再通入尾气ii。通入过量尾气i时,应打开活塞K₁, (填"关闭"或"打开")活塞K₂;干燥管内的湿润CuSO₄试纸的作用是 。
(3)通入尾气ii时,三颈烧瓶中SO₂参与反应的离子方程式为 ;通入尾气ii时,pH传感器的数据采集器显示的pH为 (填标号)时,停止通入。
a. 5.6
b. 6.4
c. 7.0
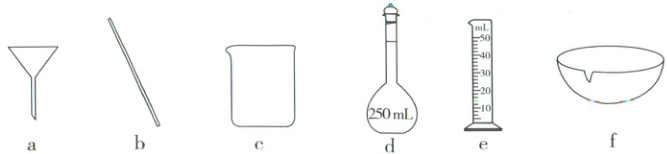
(4)取三颈烧瓶中反应后的混合液进行"一系列操作"可得硫代硫酸钠晶体,"一系列操作"过程中用不到的实验仪器有 (填标号)。
(5)利用下列方法测定所得产品纯度:
Ⅰ. 取3.6g产品,用蒸馏水配制成250mL待测溶液。
Ⅱ. 取20.00mL 0.01mol·L⁻¹K₂Cr₂O₇标准液,用稀硫酸酸化,然后加入过量KI溶液。
Ⅲ. 用步骤Ⅰ中的待测液滴定步骤Ⅱ反应后的混合液,3次平行滴定消耗待测液的平均体积为24.80mL(已知:Cr₂O₇²⁻+6I⁻+14H⁺=2Cr³⁺+3I₂+7H₂O、2S₂O₃²⁻+I₂=S₄O₆²⁻+2I⁻)。
滴定前需加入 (填试剂名称)作指示剂;产品中Na₂S₂O₃·5H₂O的纯度为 %(保留3位有效数字)。

已知:①两种尾气成分如表所示。

②硫代硫酸钠易溶于水,难溶于乙醇,在中性或碱性溶液中能稳定存在。
回答下列问题:
(1)仪器a的名称是 ;在该实验中,仪器a的作用是 。
(2)实验时,先通入过量尾气i,再通入尾气ii。通入过量尾气i时,应打开活塞K₁, (填"关闭"或"打开")活塞K₂;干燥管内的湿润CuSO₄试纸的作用是 。
(3)通入尾气ii时,三颈烧瓶中SO₂参与反应的离子方程式为 ;通入尾气ii时,pH传感器的数据采集器显示的pH为 (填标号)时,停止通入。
a. 5.6
b. 6.4
c. 7.0
(4)取三颈烧瓶中反应后的混合液进行"一系列操作"可得硫代硫酸钠晶体,"一系列操作"过程中用不到的实验仪器有 (填标号)。

(5)利用下列方法测定所得产品纯度:
Ⅰ. 取3.6g产品,用蒸馏水配制成250mL待测溶液。
Ⅱ. 取20.00mL 0.01mol·L⁻¹K₂Cr₂O₇标准液,用稀硫酸酸化,然后加入过量KI溶液。
Ⅲ. 用步骤Ⅰ中的待测液滴定步骤Ⅱ反应后的混合液,3次平行滴定消耗待测液的平均体积为24.80mL(已知:Cr₂O₇²⁻+6I⁻+14H⁺=2Cr³⁺+3I₂+7H₂O、2S₂O₃²⁻+I₂=S₄O₆²⁻+2I⁻)。
滴定前需加入 (填试剂名称)作指示剂;产品中Na₂S₂O₃·5H₂O的纯度为 %(保留3位有效数字)。
答案:
17.[答案]
(1)长颈漏斗(1分) 平衡压强(2分)
(2)关闭(1分) 检验通入的$H_2S$是否过量(2分)
(3)$4SO_2 + 2H_2S + 4HCO_3^ - =3S_2O_3^{2 - } + 4CO_2 + 3H_2O$(2分)
c(1分)
(4)de(2分)
(5)淀粉溶液(1分) 83.3(2分)
[评分标准]
(3)第一空未配平扣1分
(4)选对1个得1分,多选、错选不得分
(5)第二空有效数字位数保留错误不得分
硫代硫酸钠晶体的制备实验
(1)根据仪器a的构造可知其名称是长颈漏斗;在该实验中,长颈漏斗起到平衡压强的作用。
(2)通入过量尾气ⅱ时,需打开活塞$K_1$,关闭活塞$K_2$;干燥管内湿润的$CuSO_4$试纸起到检验通入的$H_2S$是否过量的作用,即观察到湿润的$CuSO_4$试纸变黑时[提示:$H_2S + CuSO_4=CuS\downarrow(黑色) + H_2SO_4$],停止通入尾气ⅱ。
(3)由题可知,三颈烧瓶中先发生的反应为$Na_2CO_3 + H_2S=NaHCO_3 + NaHS$,当通入尾气ⅱ时,三颈烧瓶中$SO_2$、NaHS、$NaHCO_3$发生反应生成$Na_2S_2O_3$,反应的离子方程式为$4SO_2 + 2HS^ - + 4HCO_3^ - =3S_2O_3^{2 - } + 4CO_2 + 3H_2O$;由已知信息②可知,$Na_2S_2O_3$在中性或碱性溶液中能稳定存在,通入$SO_2$时,不能过量至溶液呈酸性,溶液可以呈中性,c项正确。
(4)从反应后的混合液中获取$Na_2S_2O_3·5H_2O$,需经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,“一系列操作”过程中用不到容量瓶和量筒。
(5)因滴定反应涉及$I_2→I^ - $,故滴定前需加入的指示剂是淀粉溶液。由反应$Cr_2O_7^{2 - } + 6I^ - + 14H^+=2Cr^{3 + } + 3I_2 + 7H_2O$、$2S_2O_3^{2 - } + I_2=S_4O_6^{2 - } + 2I^ - $可得关系式$Cr_2O_7^{2 - }~6S_2O_3^{2 - }$,故滴定反应中消耗的$n(S_2O_3^{2 - }) = 6×0.02000L×0.01mol· L^{ - 1} = 0.0012mol$,则3.6g产品中$n(Na_2S_2O_3·5H_2O) = 0.0012mol×\frac{250mL}{24.8mL}$,故产品中$Na_2S_2O_3·5H_2O$的纯度为$\frac{0.0012×\frac{250}{24.8}×248}{3.6}×100\%\approx83.3\%$。
(1)长颈漏斗(1分) 平衡压强(2分)
(2)关闭(1分) 检验通入的$H_2S$是否过量(2分)
(3)$4SO_2 + 2H_2S + 4HCO_3^ - =3S_2O_3^{2 - } + 4CO_2 + 3H_2O$(2分)
c(1分)
(4)de(2分)
(5)淀粉溶液(1分) 83.3(2分)
[评分标准]
(3)第一空未配平扣1分
(4)选对1个得1分,多选、错选不得分
(5)第二空有效数字位数保留错误不得分
硫代硫酸钠晶体的制备实验
(1)根据仪器a的构造可知其名称是长颈漏斗;在该实验中,长颈漏斗起到平衡压强的作用。
(2)通入过量尾气ⅱ时,需打开活塞$K_1$,关闭活塞$K_2$;干燥管内湿润的$CuSO_4$试纸起到检验通入的$H_2S$是否过量的作用,即观察到湿润的$CuSO_4$试纸变黑时[提示:$H_2S + CuSO_4=CuS\downarrow(黑色) + H_2SO_4$],停止通入尾气ⅱ。
(3)由题可知,三颈烧瓶中先发生的反应为$Na_2CO_3 + H_2S=NaHCO_3 + NaHS$,当通入尾气ⅱ时,三颈烧瓶中$SO_2$、NaHS、$NaHCO_3$发生反应生成$Na_2S_2O_3$,反应的离子方程式为$4SO_2 + 2HS^ - + 4HCO_3^ - =3S_2O_3^{2 - } + 4CO_2 + 3H_2O$;由已知信息②可知,$Na_2S_2O_3$在中性或碱性溶液中能稳定存在,通入$SO_2$时,不能过量至溶液呈酸性,溶液可以呈中性,c项正确。
(4)从反应后的混合液中获取$Na_2S_2O_3·5H_2O$,需经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,“一系列操作”过程中用不到容量瓶和量筒。
(5)因滴定反应涉及$I_2→I^ - $,故滴定前需加入的指示剂是淀粉溶液。由反应$Cr_2O_7^{2 - } + 6I^ - + 14H^+=2Cr^{3 + } + 3I_2 + 7H_2O$、$2S_2O_3^{2 - } + I_2=S_4O_6^{2 - } + 2I^ - $可得关系式$Cr_2O_7^{2 - }~6S_2O_3^{2 - }$,故滴定反应中消耗的$n(S_2O_3^{2 - }) = 6×0.02000L×0.01mol· L^{ - 1} = 0.0012mol$,则3.6g产品中$n(Na_2S_2O_3·5H_2O) = 0.0012mol×\frac{250mL}{24.8mL}$,故产品中$Na_2S_2O_3·5H_2O$的纯度为$\frac{0.0012×\frac{250}{24.8}×248}{3.6}×100\%\approx83.3\%$。
查看更多完整答案,请扫码查看


