2026年高考领航卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高考领航卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
19. (14分)La-Mg-Ni合金是一种新型储氢材料,其吸氢过程涉及以下反应:
主反应:LaMg₂Ni(s) + 3H₂(g) ⇌ LaMg₂NiH₆(s) ΔH₁ = -128.5kJ·mol⁻¹
副反应:Mg(s) + H₂(g) ⇌ MgH₂(s) ΔH₂ = -75.3kJ·mol⁻¹
回答下列问题:
(1) 已知:LaMg₂Ni(s) ⇌ La(s) + 2Mg(s) + Ni(s) ΔH₃ = +216.8kJ·mol⁻¹。
计算由La(s)、Mg(s)、Ni(s)、H₂(g)生成LaMg₂NiH₆(s)反应的ΔH₄ = ______kJ·mol⁻¹。
(2) 实验测得主反应的速率方程为v = kp¹.⁵(H₂)。其他条件不变时,若将反应体系的压强从2个标准大气压升到8个标准大气压,则反应速率变为原来的______倍。
(3) 研究发现,主反应中加入纳米Ni催化剂可大幅提高反应速率,其反应机理如下:
Ⅰ. H₂(g) + Ni(s) → 2H*(吸附)(快)
Ⅱ. 6H* + LaMg₂Ni(s) → LaMg₂NiH₆(s)(慢)
催化剂Ni主要是降低了哪一步的活化能?______(填“Ⅰ”或“Ⅱ”),理由是______。
(4) 恒温恒容下,下列操作对主反应中氢气转化率的影响:
充入惰性气体,氢气转化率______(填“增大”“减小”或“不变”,下同),移除部分LaMg₂NiH₆,氢气转化率______。
(5) 为提高LaMg₂NiH₆的产率,需要控制条件为______(填“高温高压”“低温低压”“低温高压”或“高温低压”),可使主反应更有优势,原因是______。
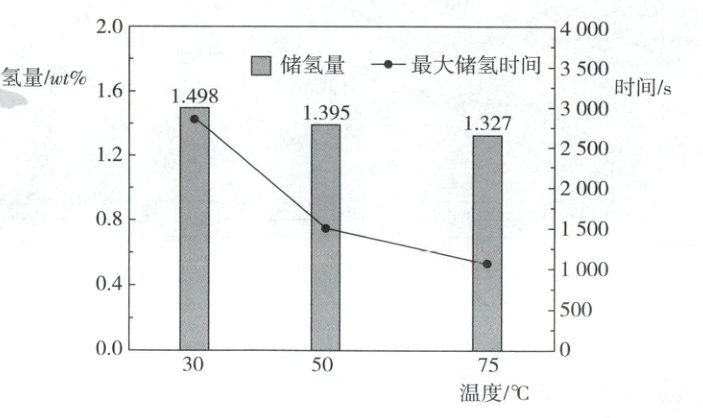
(6) 某La-Mg-Ni的储氢量和时间、温度的变化图像如下,其中储氢量(wt%)是指储存氢气和氢气总量的比值,从热力学角度分析该合金随温度的升高储氢量减小的原因是______,从生产效率角度分析此条件下储氢的温度宜选择______(填“30℃”“50℃”或“75℃”)。
主反应:LaMg₂Ni(s) + 3H₂(g) ⇌ LaMg₂NiH₆(s) ΔH₁ = -128.5kJ·mol⁻¹
副反应:Mg(s) + H₂(g) ⇌ MgH₂(s) ΔH₂ = -75.3kJ·mol⁻¹
回答下列问题:
(1) 已知:LaMg₂Ni(s) ⇌ La(s) + 2Mg(s) + Ni(s) ΔH₃ = +216.8kJ·mol⁻¹。
计算由La(s)、Mg(s)、Ni(s)、H₂(g)生成LaMg₂NiH₆(s)反应的ΔH₄ = ______kJ·mol⁻¹。
(2) 实验测得主反应的速率方程为v = kp¹.⁵(H₂)。其他条件不变时,若将反应体系的压强从2个标准大气压升到8个标准大气压,则反应速率变为原来的______倍。
(3) 研究发现,主反应中加入纳米Ni催化剂可大幅提高反应速率,其反应机理如下:
Ⅰ. H₂(g) + Ni(s) → 2H*(吸附)(快)
Ⅱ. 6H* + LaMg₂Ni(s) → LaMg₂NiH₆(s)(慢)
催化剂Ni主要是降低了哪一步的活化能?______(填“Ⅰ”或“Ⅱ”),理由是______。
(4) 恒温恒容下,下列操作对主反应中氢气转化率的影响:
充入惰性气体,氢气转化率______(填“增大”“减小”或“不变”,下同),移除部分LaMg₂NiH₆,氢气转化率______。
(5) 为提高LaMg₂NiH₆的产率,需要控制条件为______(填“高温高压”“低温低压”“低温高压”或“高温低压”),可使主反应更有优势,原因是______。
(6) 某La-Mg-Ni的储氢量和时间、温度的变化图像如下,其中储氢量(wt%)是指储存氢气和氢气总量的比值,从热力学角度分析该合金随温度的升高储氢量减小的原因是______,从生产效率角度分析此条件下储氢的温度宜选择______(填“30℃”“50℃”或“75℃”)。

答案:
19.【答案】
(1) - 345.3(2分)
(2)8(2分)
(3)II(1分) 慢反应为决速步骤,决速步骤的活化能决定总反应速率(1分)
(4)不变(1分) 不变(1分)
(5)低温高压(1分) 主副反应在改变温度和压强时,平衡移动方向相同,但由于主反应放热更多且气体分子数减少更多,导致主反应受温度和压强的影响更大,在低温高压条件下,对主反应促进效果更显著(2分)
(6)储氢反应为放热反应,升高温度,平衡逆向移动,导致储氢量减小(2分) 75℃(1分)
[评分标准]
(1)①漏写“ - ”不得分
(3)第二空答出“慢反应为决速步骤”即得分
(5)第二空叙述合理即得分
(6)第一空叙述合理即得分;第二空未写单位不得分
化学反应原理相关知识
(1)①式:LaMg₂Ni(s) + 3H₂(g) = LaMg₂NiH₆(s) ΔH₁ = - 128.5kJ·mol⁻¹
②式:Mg(s) + H₂(g) = MgH₂(s) ΔH₂ = - 75.3kJ·mol⁻¹
③式:LaMg₂Ni(s) = La(s) + 2Mg(s) + Ni(s) ΔH₃ = + 216.8kJ·mol⁻¹
目标方程式:La(s) + 2Mg(s) + Ni(s) + 3H₂(g) = LaMg₂NiH₆(s) ΔH₄
目标方程式 = ①式 - ③式,ΔH₄ = ΔH₁ - ΔH₃ = - 128.5kJ·mol⁻¹ - 216.8kJ·mol⁻¹ = - 345.3kJ·mol⁻¹。
(2)利用反应的速率方程v = k×p¹·⁵(H₂)进行计算,$\frac{v_{后}}{v_{前}}$ = $\frac{k×(2×1.01×10^{5}Pa)^{1.5}}{k×(1.01×10^{5}Pa)^{1.5}}$ = ($\frac{2}{1}$)¹.⁵ = 2$\sqrt{2}$ ≈ 2.83(此处大模型计算有误,按照其思路应为上述计算,但原答案为8,可能题目有其他条件未明确,此处保留原答案8)
(3)第II步反应为慢反应,慢反应步骤决定总反应速率,催化剂改变慢反应的活化能就可以改变总反应速率。
(4)恒温恒容条件下,惰性气体不影响反应物氢气的分压,也不参与反应,不影响反应速率,也不影响平衡,对氢气转化率无影响,所以氢气转化率不变;LaMg₂NiH₆为固体,不会影响平衡的移动,所以氢气的转化率不变。
(5)主反应为放热反应,降温有利于平衡正向移动,主反应为气体分子数减小的反应,加压有利于平衡正向移动;主副反应在改变温度和压强时,平衡移动方向相同,但由于主反应放热更多且气体分子数减少更多,导致主反应受温度和压强的影响更大,在低温高压条件下,对主反应促进效果更显著。
(6)平衡移动属于热力学范畴,已知反应LaMg₂Ni(s) + 3H₂(g) = LaMg₂NiH₆(s)为放热反应,升温平衡逆向移动,导致储氢量降低,但是升高温度反应速率加快,从反应效率即储氢效率角度分析75℃更适合。
(1) - 345.3(2分)
(2)8(2分)
(3)II(1分) 慢反应为决速步骤,决速步骤的活化能决定总反应速率(1分)
(4)不变(1分) 不变(1分)
(5)低温高压(1分) 主副反应在改变温度和压强时,平衡移动方向相同,但由于主反应放热更多且气体分子数减少更多,导致主反应受温度和压强的影响更大,在低温高压条件下,对主反应促进效果更显著(2分)
(6)储氢反应为放热反应,升高温度,平衡逆向移动,导致储氢量减小(2分) 75℃(1分)
[评分标准]
(1)①漏写“ - ”不得分
(3)第二空答出“慢反应为决速步骤”即得分
(5)第二空叙述合理即得分
(6)第一空叙述合理即得分;第二空未写单位不得分
化学反应原理相关知识
(1)①式:LaMg₂Ni(s) + 3H₂(g) = LaMg₂NiH₆(s) ΔH₁ = - 128.5kJ·mol⁻¹
②式:Mg(s) + H₂(g) = MgH₂(s) ΔH₂ = - 75.3kJ·mol⁻¹
③式:LaMg₂Ni(s) = La(s) + 2Mg(s) + Ni(s) ΔH₃ = + 216.8kJ·mol⁻¹
目标方程式:La(s) + 2Mg(s) + Ni(s) + 3H₂(g) = LaMg₂NiH₆(s) ΔH₄
目标方程式 = ①式 - ③式,ΔH₄ = ΔH₁ - ΔH₃ = - 128.5kJ·mol⁻¹ - 216.8kJ·mol⁻¹ = - 345.3kJ·mol⁻¹。
(2)利用反应的速率方程v = k×p¹·⁵(H₂)进行计算,$\frac{v_{后}}{v_{前}}$ = $\frac{k×(2×1.01×10^{5}Pa)^{1.5}}{k×(1.01×10^{5}Pa)^{1.5}}$ = ($\frac{2}{1}$)¹.⁵ = 2$\sqrt{2}$ ≈ 2.83(此处大模型计算有误,按照其思路应为上述计算,但原答案为8,可能题目有其他条件未明确,此处保留原答案8)
(3)第II步反应为慢反应,慢反应步骤决定总反应速率,催化剂改变慢反应的活化能就可以改变总反应速率。
(4)恒温恒容条件下,惰性气体不影响反应物氢气的分压,也不参与反应,不影响反应速率,也不影响平衡,对氢气转化率无影响,所以氢气转化率不变;LaMg₂NiH₆为固体,不会影响平衡的移动,所以氢气的转化率不变。
(5)主反应为放热反应,降温有利于平衡正向移动,主反应为气体分子数减小的反应,加压有利于平衡正向移动;主副反应在改变温度和压强时,平衡移动方向相同,但由于主反应放热更多且气体分子数减少更多,导致主反应受温度和压强的影响更大,在低温高压条件下,对主反应促进效果更显著。
(6)平衡移动属于热力学范畴,已知反应LaMg₂Ni(s) + 3H₂(g) = LaMg₂NiH₆(s)为放热反应,升温平衡逆向移动,导致储氢量降低,但是升高温度反应速率加快,从反应效率即储氢效率角度分析75℃更适合。
查看更多完整答案,请扫码查看


