2026年高考领航卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高考领航卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
16. (14分)锗是一种具有重要战略价值的稀有金属,广泛应用于半导体、光电子和航天等领域。利用某锌浸渣(主要含有ZnFe₂O₄、GeO₂、SiO₂等)提取Ge的流程如图1所示。
已知:
①含锗微粒的存在形式与pH的关系如下:
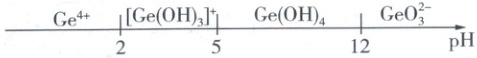
②部分金属离子形成氢氧化物沉淀的pH范围如表:

回答下列问题:
(1) Ge在元素周期表中的位置为______。滤渣1的主要成分是______。
(2) ZnFe₂O₄在“还原浸出”步骤中发生反应的化学方程式为______。
(3) 滤渣2的主要成分的化学式是______;“沉锗”操作理论上需控制pH范围为______。
(4) 萃取反应原理为Ge⁴⁺ + 3C₄H₆O₆ ⇌ [Ge(C₄H₄O₆)₃]²⁻ + 6H⁺。酒石酸的结构简式为HOOCCH(OH)CH(OH)COOH,每个[Ge(C₄H₄O₆)₃]²⁻中含______个C—O σ键;pH过大或过小,锗的萃取率均会下降,原因是______;“反萃取”步骤中使用的碱是______(填电子式)。
(5) 一种锗晶胞结构如图2所示,Ge原子的空间利用率为______;沿图2所示的体对角线投影,B原子在图3上的位置是______(填1~6中的某个数字)。



已知:
①含锗微粒的存在形式与pH的关系如下:
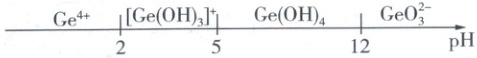
②部分金属离子形成氢氧化物沉淀的pH范围如表:

回答下列问题:
(1) Ge在元素周期表中的位置为______。滤渣1的主要成分是______。
(2) ZnFe₂O₄在“还原浸出”步骤中发生反应的化学方程式为______。
(3) 滤渣2的主要成分的化学式是______;“沉锗”操作理论上需控制pH范围为______。
(4) 萃取反应原理为Ge⁴⁺ + 3C₄H₆O₆ ⇌ [Ge(C₄H₄O₆)₃]²⁻ + 6H⁺。酒石酸的结构简式为HOOCCH(OH)CH(OH)COOH,每个[Ge(C₄H₄O₆)₃]²⁻中含______个C—O σ键;pH过大或过小,锗的萃取率均会下降,原因是______;“反萃取”步骤中使用的碱是______(填电子式)。
(5) 一种锗晶胞结构如图2所示,Ge原子的空间利用率为______;沿图2所示的体对角线投影,B原子在图3上的位置是______(填1~6中的某个数字)。



答案:
16.[答案]
(1)第四周期ⅣA族(1分) SiO₂(1分)
(2)ZnFe₂O₄ + SO₂ + 2H₂SO₄ ══ ZnSO₄ + 2FeSO₄ + 2H₂O(2分)
(3)CaSO₄(1分) 5 < pH < 6.2(2分)
(4)12(1分) pH过大,Ge以[Ge(OH)₄]⁻等形式存在,难以与酒石酸形成配合物;pH过小,生成[Ge(C₄H₄O₆)₃]²⁻的反应平衡逆向移动(2分) Na⁺[:Ö:H]⁻(1分)
$(5)\frac{\sqrt{3}π}{16}(2$分) 4(1分)
[评分标准]
(1)第二空填名称也得分
(2)反应物和生成物均正确但未配平扣1分
(3)第一空填名称不得分;第二空答“5~6.2”也得分
(4)第一空答“十二”也得分;第二空叙述合理即可;第三空其他形式不得分
(5)第一空其他合理答案也得分
流程梳理一 元素化合物性质等
元素化合物性质等
(1)Ge的原子序数是32,位于元素周期表中第四周期ⅣA族。由上述分析知,ZnFe₂O₄、GeO₂溶于硫酸,而SiO₂不溶于硫酸,故滤渣1的主要成分是SiO₂。
(3)CaSO₄是微溶物,滤渣2的主要成分是CaSO₄。由已知①可知,5 < pH < 12时,含锗微粒以Ge(OH)₄(沉淀)的形式存在,但为了避免Fe²⁺、Zn²⁺沉淀,pH应小于6.2,故“沉锗”操作理论上需控制pH范围为5 < pH < 6.2。
(4)[Ge(C₄H₄O₆)₃]²⁻中每个配体含4个C—Oσ键[注意:C—Oσ键不包括C=O中的σ键],1个[Ge(C₄H₄O₆)₃]²⁻含有3个配体,故共有12个C—Oσ键。pH过大,Ge以[Ge(OH)₄]⁻、Ge(OH)₄等形式存在,难以与酒石酸形成配合物;pH过小,生成[Ge(C₄H₄O₆)₃]²⁻的反应平衡逆向移动,均会使锗的萃取率下降。
(5)锗晶胞与金刚石晶胞类似,1个锗晶胞含有的Ge原子数为$8×\frac{1}{8} + 6×\frac{1}{2} + 4 = 8。$设Ge的原子半径为r,晶胞参数为a,则$8r = \sqrt{3}a,$$a = \frac{8r}{\sqrt{3}},$故空间利用率$ = \frac{8×\frac{4}{3}πr³}{(\frac{8r}{\sqrt{3}})³}×100% = \frac{\sqrt{3}π}{16}。$图3中2号位置为晶胞体对角线所在位置,结合图2和图3中A、C原子的位置可知,B原子投影的位置是图3的4号位。
16.[答案]
(1)第四周期ⅣA族(1分) SiO₂(1分)
(2)ZnFe₂O₄ + SO₂ + 2H₂SO₄ ══ ZnSO₄ + 2FeSO₄ + 2H₂O(2分)
(3)CaSO₄(1分) 5 < pH < 6.2(2分)
(4)12(1分) pH过大,Ge以[Ge(OH)₄]⁻等形式存在,难以与酒石酸形成配合物;pH过小,生成[Ge(C₄H₄O₆)₃]²⁻的反应平衡逆向移动(2分) Na⁺[:Ö:H]⁻(1分)
$(5)\frac{\sqrt{3}π}{16}(2$分) 4(1分)
[评分标准]
(1)第二空填名称也得分
(2)反应物和生成物均正确但未配平扣1分
(3)第一空填名称不得分;第二空答“5~6.2”也得分
(4)第一空答“十二”也得分;第二空叙述合理即可;第三空其他形式不得分
(5)第一空其他合理答案也得分
流程梳理一
 元素化合物性质等
元素化合物性质等 (1)Ge的原子序数是32,位于元素周期表中第四周期ⅣA族。由上述分析知,ZnFe₂O₄、GeO₂溶于硫酸,而SiO₂不溶于硫酸,故滤渣1的主要成分是SiO₂。
(3)CaSO₄是微溶物,滤渣2的主要成分是CaSO₄。由已知①可知,5 < pH < 12时,含锗微粒以Ge(OH)₄(沉淀)的形式存在,但为了避免Fe²⁺、Zn²⁺沉淀,pH应小于6.2,故“沉锗”操作理论上需控制pH范围为5 < pH < 6.2。
(4)[Ge(C₄H₄O₆)₃]²⁻中每个配体含4个C—Oσ键[注意:C—Oσ键不包括C=O中的σ键],1个[Ge(C₄H₄O₆)₃]²⁻含有3个配体,故共有12个C—Oσ键。pH过大,Ge以[Ge(OH)₄]⁻、Ge(OH)₄等形式存在,难以与酒石酸形成配合物;pH过小,生成[Ge(C₄H₄O₆)₃]²⁻的反应平衡逆向移动,均会使锗的萃取率下降。
(5)锗晶胞与金刚石晶胞类似,1个锗晶胞含有的Ge原子数为$8×\frac{1}{8} + 6×\frac{1}{2} + 4 = 8。$设Ge的原子半径为r,晶胞参数为a,则$8r = \sqrt{3}a,$$a = \frac{8r}{\sqrt{3}},$故空间利用率$ = \frac{8×\frac{4}{3}πr³}{(\frac{8r}{\sqrt{3}})³}×100% = \frac{\sqrt{3}π}{16}。$图3中2号位置为晶胞体对角线所在位置,结合图2和图3中A、C原子的位置可知,B原子投影的位置是图3的4号位。
查看更多完整答案,请扫码查看


